
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A. B.
B.![]() C.
C.![]() D.
D.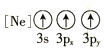
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与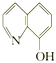 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
【答案】3d104s24p3 D 正四面体 O N sp2 AlF3、GaF3为离子晶体,AlCl3为分子晶体,晶格能:AlF3>GaF3, 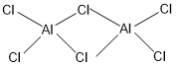 4
4
【解析】
(1) As为33号元素,原子核外电子数为33,其核外电子排布式为1s22s22p63s23p63d104s24p3;能量越高越不稳定,越易失电子,所以激发态的微粒易失电子,原子轨道中处于半满状态时较稳定;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;元素的非金属性越强,电负性越大,而金属性越强,通常第一电离能最小;根据分子结构中N原子成键数和孤对电子数判断杂化方式;
=4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;元素的非金属性越强,电负性越大,而金属性越强,通常第一电离能最小;根据分子结构中N原子成键数和孤对电子数判断杂化方式;
(3)通常离子晶体的熔点大于分子晶体,离子晶体的晶格能大熔点高;
②二聚体Al2Cl6中Al原子有空轨道,Cl可以提供孤电子对形成配位键;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目。
(1) 基态As原子核外有33个电子,电子排布式为1s22s22p63s23p63d104s24p3,即[Ar] 3d104s24p3;A为失去两个电子后的状态, B为失去一个电子后的状态,C为失去三个电子后的状态, D为有一个电子的跃迁的激发态,A电离最外层一个电子所需能量实际就是第三电离能,B电离最外层一个电子所需能量实际就是第二电离能,C电离最外层一个电子所需能量实际就是第四电离能,D电离最外层一个电子所需能量为处于激发态的1个电子,所以需要能量最大的是C,最小的是D,故答案为D;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,sp3杂化,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形; 8—羟基喹啉合铝中所含元素分别是C、H、N、O和Al元素,其中氧元素的非金属性最强,则电负性最大的是O;Al是金属元素,易失电子,第一电离能较小,而非金属元素第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O,则N元素的第一电离能最大;分子中N原子的成键数是2和孤对电子数是1,杂化轨道数目为3,N原子采取sp2杂化;
=4且不含孤电子对,sp3杂化,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形; 8—羟基喹啉合铝中所含元素分别是C、H、N、O和Al元素,其中氧元素的非金属性最强,则电负性最大的是O;Al是金属元素,易失电子,第一电离能较小,而非金属元素第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O,则N元素的第一电离能最大;分子中N原子的成键数是2和孤对电子数是1,杂化轨道数目为3,N原子采取sp2杂化;
(3)①表格中卤化物的熔点产生差异的原因是AlF3和GaF3是离子晶体,且晶格能AlF3>GaF3,则AlF3的熔点比GaF3高,而AlCl3是分子晶体,其熔点明显比AlF3和GaF3的熔点低;
②熔融时AlCl3生成可挥发的二聚体Al2Cl6,该二聚体由Al提供空轨道,Cl原子提供电子对形成配位键,其结构式为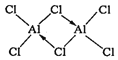 ;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4。
;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如图所示,图中M点对应的pH为a,下列说法正确的是( )
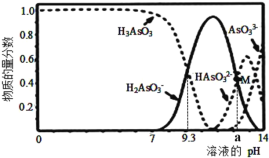
A.H3AsO3的电离常数Ka1的数量级为10-9
B.pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C.M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D.pH=12 时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是( )

A.Fe+4H++NO3-=Fe3++NO↑+2H2O
B.Fe(OH)3+3H+=Fe3++3H2O
C.Fe3O4+8H+=Fe2++2Fe3++4H2O
D.3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见的病毒与细菌。下面有关该物质的说法正确的是
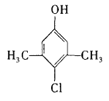
A. 该物质的分子式是C8H10ClO
B. 1mol该物质最多可以与2mol NaOH反应
C. 1mol该物质可以与2mol液溴发生取代反应
D. 该物质可以发生加成、取代、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的铁和铜的混合物24g与600mL稀硝酸恰好完全反应,生成NO6.72L(标准状况)。向反应后的溶液中加入1molL-1NaOH溶液使金属离子恰好沉淀。下列有关说法错误的是( )
A.混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1
B.稀硝酸的物质的量浓度度是2molL-1
C.需要加入NaOH溶液1000mL
D.最后所得沉淀在空气中充分加热可得固体32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。
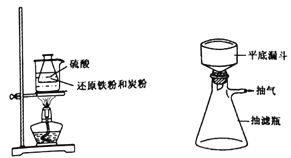
步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______,加人6 mol·L-1硫酸的作用是____________。
(2)向滤液中加人无水乙醇目的是_________________。
(3)产品中金属阳离子的检验方法及现象________________。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________,制得硫酸亚铁钱样品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
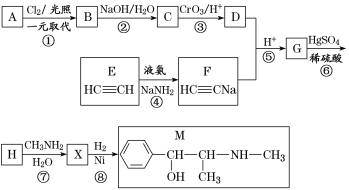
已知:Ⅰ.芳香烃A的相对分子质量为92
Ⅱ.R—CH2OH![]() RCHO
RCHO
III、R1-CHO+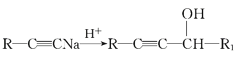
IV、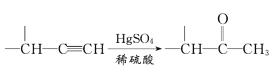
V、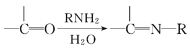
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
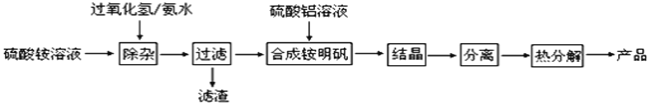
(1)“除杂”操作是加入H2O2后,然后用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中少量的Fe2+。
①酸性溶液中Fe2+与H2O2反应的离子方程式为___。
②过滤操作中所得到滤渣主要成分的化学式为___。
(2)检验上述流程中“过滤”后杂质是否除尽的实验方法___。
(3)配制硫酸铝溶液时,需用硫酸酸化的目的是___。
(4)“结晶”操作中,得到铵明矾晶体(NH4Al(SO4)212H2O),采用的操作是___。
(5)铵明矾晶体的化学式为NH4Al(SO4)212H2O,在0.1mol/L铵明矾的水溶液中,c(NH4+)、c(Al3+)、c(SO42﹣)三种离子浓度由大到小的顺序为___。
Kb(NH3·H2O)=1.8×10-5KbAl(OH)3=1.38×10-9
(6)向铵明矾溶液中加入过量NaOH溶液,反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com