
A、 制氨气 |
B、 收集CO2或NO |
C、 配制稀硫酸 |
D、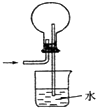 氨气的吸收 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:Na+、CO32-、SO32-、K+ |
| B、石蕊呈红色的溶液:ClO-、Na+、SO32-、Cl- |
| C、PH>7的溶液中:Mg2+、Br-、K+、Al3+ |
| D、加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
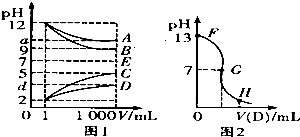 物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:
物质A-E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000mL,pH的变化如图l所示,其中A与D反应得到E.请回答:| 阳离子 |
| ||
| 阴离子 | OH-、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
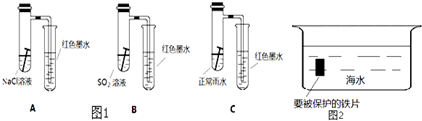
查看答案和解析>>
科目:高中化学 来源: 题型:
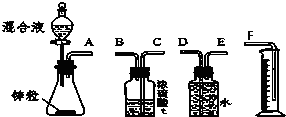 某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.| 混合溶液组成 | A组 | B组 | C组 | D组 | E组 | F组 |
| 4mol/LH2SO4 | 30mL | V1 mL | V2 mL | V3 mL | V4 mL | V5 mL |
| 饱和CuSO4溶液 | 0mL | 0.5mL | 2.5mL | 5mL | V6 mL | 20mL |
| H2O | V7 mL | V8 mL | V9 mL | V10 mL | 10mL | 0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com