某氧化铁样品中含有少量的FeCl
2杂质.现要测定其中铁元素的质量分数,按以下步骤进行实验:
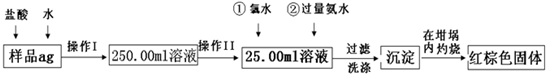
请根据图的流程,回答下列问题:
(1)操作I所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有
250mL容量瓶
250mL容量瓶
;(填仪器名称)操作II必须用到的仪器是
D
D
.(填字母)
A.50ml烧杯 B.50ml量筒 C.100ml量筒 D.25ml滴定管
(2)先加入足量氯水再加入氨水的离子方程式为
2Fe 2++Cl2=2Fe 3++2Cl-、Fe3++3NH3H2O=Fe(OH)3↓+3NH4+
2Fe 2++Cl2=2Fe 3++2Cl-、Fe3++3NH3H2O=Fe(OH)3↓+3NH4+
.
(3)检验沉淀是否洗涤干净的操作是
取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净
取少量最后一次洗出液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净
.
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b
1g,再次加热并冷却至室温称量其质量为b
2g,若b
1-b
2=0.3,则接下来还应进行的操作是
继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g
继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g
.
(5)若坩埚的质量为W
1g,坩埚与加热后固体的总质量为W
2g,则样品中铁元素的质量分数是
.
(6)有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,加热蒸干燃烧称量即可,请你评价是否可行?
可行
可行
.(填“可行”或“不可行”)

 阅读快车系列答案
阅读快车系列答案