
分析 (1)根据n=$\frac{m}{M}$计算无水芒硝的物质的量,根据硫元素守恒计算得到Na2S的物质的量,再根据m=nM计算Na2S的质量;
(2)若生成的气体为CO,消耗的碳的物质的量最多,若生成的气体为CO2,消耗的碳的物质的量最少;若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒计算需要碳的物质的量;若生成等物质的量CO和CO2,根据电子转移守恒计算CO和CO2的物质的量,再根据碳原子守恒计算碳的物质的量;
(3)计算CO 和 CO2各自的物质的量,再根据电子转移守恒列等式,确定x 与 y的关系;
(4)Na2S与Na2SO3在酸性条件下发生反应:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O,故19.2g为硫的质量,放出H2S气体2.24L,还发生反应2HCl+Na2S=2NaCl+H2S↑,根据n=$\frac{m}{M}$计算S的物质的量,进而计算生成S的反应中参加反应的Na2S、Na2SO3各自的物质的量,根据n=$\frac{V}{Vm}$计算H2S的物质的量,进而计算与盐酸反应生成H2S气体需要Na2SO3的物质的量,再根据m=nM计算样品中Na2S、Na2SO3各自的质量,继而计算Na2SO4的质量,根据n=$\frac{m}{M}$计算Na2SO4的物质的量.
解答 解:(1)无水芒硝17.75g的物质的量=$\frac{17.75g}{142g/mol}$=0.125mol,若生成过程中无水芒硝的利用率为80%,根据硫元素守恒可知,则理论上可得到 Na2S的质量是0.125mol×80%×78g/molg/mol=7.8g,根据反应方程式:Na2SO4+4C=Na2S+4CO,最多生成一氧化碳物质的量是0.125mol×80%×4=0.4mol,体积是8.96L,故答案为:7.8,8.96;
(2)若生成的气体为CO,消耗的碳的物质的量最多,由Na2SO4+4C$\frac{\underline{\;高温\;}}{\;}$Na2S+4CO↑可知,生成3molNa2S需要碳的物质的量为3mol×4=12mol,若生成的气体为CO2,消耗的碳的物质的量最少,根据电子转移守恒可知,生成3molNa2S需要碳的物质的量为6mol,故消耗的碳单质的物质的量 n的范围是6mol≤n≤12mol;
若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒可知,生成3molNa2S需要碳的物质的量为$\frac{3mol[6-(-2)]}{4}$=6mol;
若生成等物质的量CO和CO2,令各自物质的量为ymol,根据电子注意守恒,则2y+4y=3×[6-(-2)],解得y=4,根据碳原子守恒可知,需要碳的物质的量为4mol+4mol=8mol,
故答案为:6;12;8;
(3)19.2g为硫的物质的量是0.6mol,由方程式:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O可知,参加该反应的Na2S为0.6mol×$\frac{2}{3}$=0.4mol,Na2SO3的物质的量为0.6mol×$\frac{1}{3}$=0.2mol,2.24LH2S气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据反应2HCl+Na2S=2NaCl+H2S↑可知,参加该反应的Na2S的物质的量为0.1mol,故样品中Na2SO4的质量为78.40g-0.2mol×126g/mol-(0.4mol+0.1mol)×78g/mol=14.2g,故Na2SO4的物质的量为$\frac{14.2g}{142g/mol}$=0.1mol,
故78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol,
答:78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol.
点评 本题考查混合物的有关计算,注意利用极限法与守恒法进行的计算,是对学生综合能力的考查,难度中等.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | X可用新制的氢氧化铜悬浊液检验 | |
| B. | 实验室由Y和M制取乙酸乙酯时可用饱和Na2CO3溶液来提纯 | |
| C. | 乙酸乙酯的同分异构体中含有“-COO-”结构的还有3种 | |
| D. | Y分子中含有3种不同环境的氢,峰面积比为3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
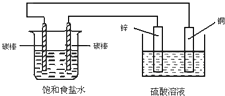
| A. | 电子经导线从锌片流向右侧碳棒,再从左侧碳棒流回铜片 | |
| B. | 铜片上发生氧化反应 | |
| C. | 右侧碳棒上发生的反应:2H++2e→H2↑ | |
| D. | 铜电极出现气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.8g滤渣是由3.2g铜和1.6g铁组成 | B. | ω=14.7 | ||
| C. | 反应过程中产生的氢气是2.24L | D. | 滤液是20.88%的硫酸亚铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(S04)3溶液中加入过量氨水:A3++4NH3•H2O═AlO-+4NH4++2H2O | |
| B. | 少量双氧水滴人酸性KI溶液:2H202+2I-═2H++4H20+I2 | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-═3Fe3++NO+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一═2MnOOH+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
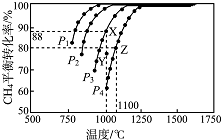 现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | △H>0 | |
| B. | P4>P3>P2>Pl | |
| C. | 1000℃,P3条件下,在Y点:v(正)<v(逆) | |
| D. | 1100℃,P4条件下,该反应的平衡常数K=l.64 (mol/L)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
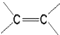 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 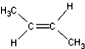 是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H2Cl4的化合物的链状异构体有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com