
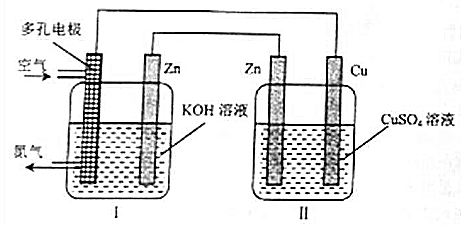
| A. | Cu电极质量增加 | |
| B. | 装置Ⅱ将化学能转变为电能 | |
| C. | 装置Ⅰ中OH-向多孔电极移动 | |
| D. | 多孔电极的电极反应式为:O2+4e-+2H2O═4OH- |
分析 装置Ⅰ中Zn电极产生ZnO,则装置Ⅰ为原电池,Zn易失电子作负极,多孔电极为正极,所以装置Ⅱ为电解池,与锌相连的锌为阴极得电子发生还原反应,与多孔电极向连的铜为阳极失电子发生氧化反应,据此分析解答.
解答 解:A.根据以上分析,铜为阳极失电子发生氧化反应,则Cu电极质量减小,故A错误;
B.装置Ⅱ为电解池,将电能转变为化学能,故B错误;
C.装置Ⅰ为原电池,则OH-向负极Zn移动,故C错误;
D.多孔电极为正极,发生还原反应,电极反应式为:O2+4e-+2H2O═4OH-,故D正确;
故选D.
点评 本题考查了原电池和电解池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 盛放氢氧化钠溶液的试剂瓶用橡胶塞 | 氢氧化钠可以与玻璃中的二氧化硅反应生成粘性的硅酸钠 | Ⅰ对,Ⅱ错,无 |
| B | 氯水可以使有色布条褪色 | 氯气具有漂白性 | Ⅰ错,Ⅱ对,有 |
| C | 二氧化硅可以与水反应生成硅酸 | 二氧化硅是酸性氧化物具有酸性氧化物的通性 | Ⅰ对,Ⅱ对,无 |
| D | 为增强漂白能力使用漂白粉时向漂白粉溶液中加入少量白醋 | 醋酸的酸性比次氯酸强 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
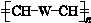 (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: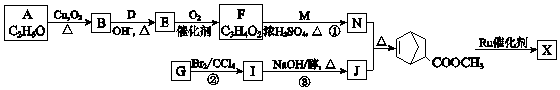
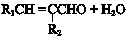
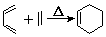
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$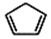 +2 NaBr+2 H2O.
+2 NaBr+2 H2O.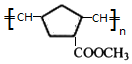 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
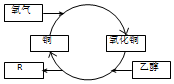
| A. | R的化学式为C2H4O | |
| B. | 乙醇发生了还原反应 | |
| C. | 反应过程中固体有红黑交替变化的现象 | |
| D. | 乙二醇(HO-CH2-CH2-OH)也能发生类似反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
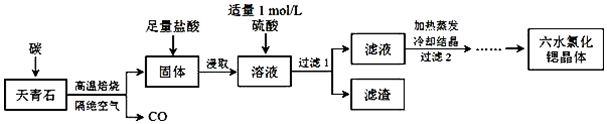
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸检测:0.1mol•L-1Na2SO3溶液、0.1mol•L-1NaHSO3溶液 | Na2SO3溶液的pH约为10; NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com