
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
分析 (2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,如果不发生氧化还原反应,溶液呈黄色是由溴水引起的,如果发生反应:2Fe2++Br2═2Fe3++2Br-,生成Fe3+,溶液呈黄色是由Fe3+引起的.即可得出甲同学、乙同学的结论;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2Fe2++Br2═2 Fe3++2Br-,要设计方案进行实验证明乙同学的观点确实正确,考虑两种思路.第一,溶液中不存在Br2,然后选择合适试剂检验不存在Br2.第二,溶液中存在Fe3+,选择合适试剂检验存在Fe3+.即可确定乙同学观点正确;
(4)①根据氧化还原反应原理确定反应物及其生成物,利用化合价升降法进行配平即可;
②氯气的物质的量是$\frac{2.24L}{22.4L/mol}$=0.1mol,因还原性Fe2+>Br-,溶液中有$\frac{1}{3}$的Br-被氧化成单质Br2,先后发生2Fe2++Cl2═2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,结合电子得失守恒计算.
解答 解:(2)Fe2+的颜色:浅绿色,Fe3+的颜色:棕黄色,溴水的颜色:橙黄色.
根据题意在足量的氯化亚铁溶液中加入l-2滴溴水,若Fe3+氧化性强于Br2,则不发生氧化还原反应,溶液呈黄色是由加入溴水引起的;如果Br2氧化性强于Fe3+,则发生反应:2Fe2++Br2═2Fe3++2Br-,生成了Fe3+,则溶液呈黄色是由Fe3+引起的;
因此①中甲同学认为氧化性:Fe3+>Br2,不发生反应,溶液呈黄色是由溴水引起的;②中乙同学认为氧化性:Fe3+<Br2,发生反应生成Fe3+,溶液呈黄色是由Fe3+引起的,
故答案为:Br2;Fe3+;
(3)乙同学的观点认为氧化性:Fe3+<Br2,则会发生反应:2Fe2++Br2═2Fe3++2Br-,由于溴水少量,要全部参与反应,生成物中生成了Fe3+.
要证明乙同学的观点确实正确,设计两种方案进行实验.方案一:证明溶液中不存在Br2,根据题意,选择试剂四氯化碳来进行萃取实验,由于四氯化碳呈无色、密度大于水、与水不互溶、易溶解Br2,观察到现象为:出现分层现象,下层为四氯化碳,且呈无色.则证明方案一正确.
方案二:证明溶液中存在Fe3+.根据题意,选择试剂硫氰化钾溶液,观察到现象为溶液呈血红色.则证明方案二正确.方案一、方案二都正确即可证明乙同学的观点确实正确.
故答案为:
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
点评 本题考查氧化还原反应基础知识,联系元素及其化合物,设计探究实验,判断氧化性、还原性的强弱.需具备一定的实验能力和综合思维能力,尤其是氧化性、还原性强弱的判断及根据量的不同书写离子方程式,非常容易出错,需要注意多练习.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | N2的电子式: | |
| C. | S2-的结构示意图: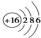 | |
| D. | 丙醛的结构简式:CH3CH2COH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
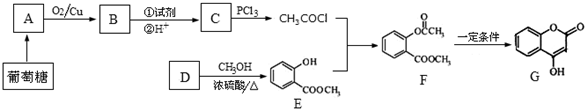
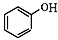 +NaOH→
+NaOH→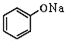 +H2O
+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 维生素A能发生取代、加成、酯化反应 | |
| B. | 维生素A不能与金属钠反应产生氢气 | |
| C. | 维生素A不能使酸性KMnO4溶液褪色 | |
| D. | 维生素A属于不饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com