
下列根据实验现象得出的结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有漂白性 |
B | C2H5OH与浓硫酸混合后加热到170℃ | 生成的气体使酸性KMnO4溶液褪色 | 反应一定生成了乙烯 |
C | 向KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊 | 试纸变为蓝色 | NO3-被还原为NH3 |
D | 向NaSiO3溶液中滴加I滴酚酞试液,然后逐滴加入稀盐酸至红色褪去 | 产生胶装沉淀 | 非金属性:Cl>Si |
科目:高中化学 来源: 题型:解答题
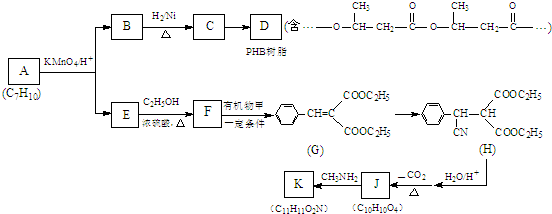
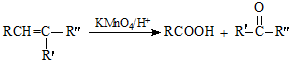

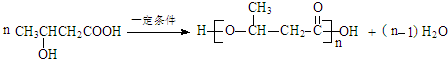 .
.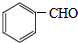 .
. .
.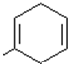 .
.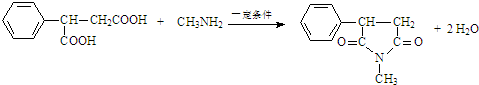 .
.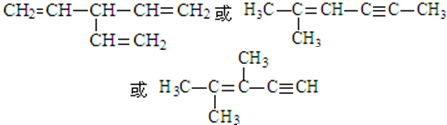 (写出一种即可).
(写出一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )| A. | HMX分子式为C4N8O8 | |
| B. | HMX中,所有C、N原子共平面 | |
| C. | 爆炸反应是,N2既是还原产物又是氧化产物 | |
| D. | 29.6gHMX完全燃烧产生二氧化碳8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
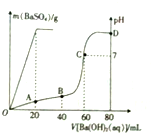 常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.
常温下,向80mL由盐酸和硫酸组成的混合溶液中加入0.4 mol•L-1的Ba(OH)2溶液,生成BaSO4沉淀的质量及溶液pH随加入Ba(OH)2溶液的体积的关系如图所示.查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:

回答下列问题:
(1)煅烧硫化亚铁若生成Fe2O3和SO2,则生成标准状况下11.2L SO2气体,转移电子的物质的量为____________。
(2)该流程中加入铁粉的作用是____________(用离子方程式表示)。
(3)已知四种盐的溶解度随温度变化的曲线如图所示。请回答下列问题:
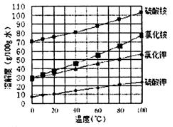
①向滤液II中加入NH4HCO3溶液所发生反应的离子方程式是________________。
②向(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为_________、________、洗涤、干燥等;反应的化学方程式为_______________。
(4)用含少量硫酸亚铁和硫酸铁的硫酸铜溶液制备CuSO4·5H2O的流程如下:

加入试剂X的目的是_____,调节溶液pH的试剂Y可能是_____(填字母编号)。
a.NaOH
b.CuO
c.NH3·H2O
d.Cu(OH)2CO3
Cu2+为0.2mol·L-1的溶液,欲除尽Fe3+(当离子浓度小于1*10-5mol·L-1时,离子已沉淀完全,)调整溶液pH的精确范围是_____(已知:Kap[Cu(OH)2]=2×10-20,Kap[Fe(OH)3]=8.0×10-38,lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:简答题
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ·mol-1
CO(g)+1/2O2(g)=CO2(g)△H2=bkJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ·mol-1
则C的燃烧热________kJ·mol-1
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2C03与C02为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:
2NH3(g)△H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol(体积比1:1)充入5L合成塔中。反应前压强为P。,反应过程中压强用P表示,反应过程中P/P。与时间t的关系如下图所示。请回答下列问题:

①反应达平衡的标志是(填字母代号)。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为。
③若提高N2的转化率可采取的措施有。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大E.加入一定量的N2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com