
 已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:
| ||
| ||


科目:高中化学 来源: 题型:
| 时间/h | 0.5 | 1 | 1.5 | 2 |
| pH | 1.3 | 2.4 | 3.0 | 3.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| v |
| 2 |
| A、2:1 | B、3:2 |
| C、3:4 | D、5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |


查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:
科学家预言,燃料电池是21世纪获得电能的重要途径.一种甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如下:查看答案和解析>>
科目:高中化学 来源: 题型:
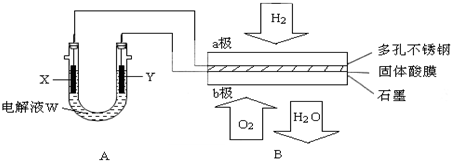
查看答案和解析>>
科目:高中化学 来源: 题型:

 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和VⅡ,结构简式分别是为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
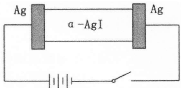 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com