
分析 (1)一定条件下,充入2.0mol SO2(g) 和2.0mol O2(g),20s后达平衡,测得SO3的体积分数为12.5%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 2 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 2-x 2x
故 $\frac{2-2x}{4-x}$=12.5%,解得x=0.8,再根据v=$\frac{△c}{△t}$计算v(SO2);
(2)化学平衡常数是平衡时生成物浓度幂之积比反应物浓度幂之积,所以K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$计算平衡常数;若降温平衡常数增大,则平衡正向移动,正反应为放热反应;
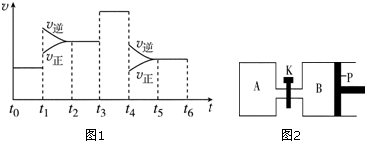
(3)如图1表示该反应的速率(v)随时间(t)的变化的关系:据图分析:t1时正逆反应速率增大,而反应是放热反应,所以t1时是升高温度,t3时正逆反应速率同等程度增大,而反应前后两边的计量数不等,所以t3时使用催化剂t4改变的条件是减小压强;t6时保持体积不变向体系中充入少量He气,各组分的浓度不变,平衡不移动,SO3%含量最高的区间是t0~t1;
(4)根据恒温恒压条件下,气体的物质的量之比等于容器的容积之比计算出消耗的三氧化硫的物质的量;根据等效平衡的知识判断6mol三氧化硫达到平衡时容器的体积,然后计算出打开K后容器B的体积.
解答 解:(1)一定条件下,充入2.0mol SO2(g) 和2.0mol O2(g),20s后达平衡,测得SO3的体积分数为12.5%,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 2 0
变化量(mol):2x x 2x
平衡量(mol):2-2x 2-x 2x
故$\frac{2-2x}{4-x}$=12.5%,解得x=0.8,v(SO2)=$\frac{△c}{△t}$=$\frac{\frac{2×0.8mol}{2L}}{20s}$=0.04mol/(L•s),故答案为:0.04;
(2)化学平衡常数是平衡时生成物浓度幂之积比反应物浓度幂之积,所以K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;若降温平衡常数增大,则平衡正向移动,正反应为放热反应,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$;<;
(3)如图1表示该反应的速率(v)随时间(t)的变化的关系:据图分析:t1时正逆反应速率增大,但增大程度不同,逆反应速率增大的大,反应是放热反应,所以t1时改变的条件是升温,t3时正逆反应速率同等程度增大,而反应前后两边的计量数不等,所以t3时使用催化剂t4改变的条件是减小压强,t6时保持体积不变向体系中充入少量He气,各组分的浓度不变,平衡不移动,上述分析可知,SO3%含量最高的区间是t0~t1,
故答案为:升高温度;不;t0~t1;
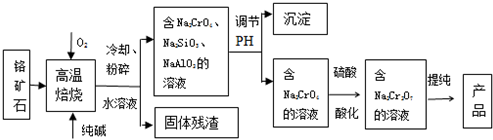
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)?2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:$\frac{0.8mol}{2mol}$×100%=40%,
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:$\frac{6mol}{2mol}$×1.2a=3.6a,所以容器B的体积为:3.6a-a=2.6a,
故答案为:2.6a.
点评 本题考查了化学平衡的计算知识,题目难度中等,主要是有效化学平衡因素分析,平衡加水应用,充分反映学生对所学知识的掌握情况.


科目:高中化学 来源: 题型:选择题
| A. | 玻璃是人类是早使用的硅酸盐材料 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| D. | 普通水泥的成分主要是硅酸钠、硅酸钙和二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟是非金属性最强的元素.
氟是非金属性最强的元素.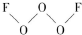 ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 | B. | 0.8mol•L-1 | C. | 0.6mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
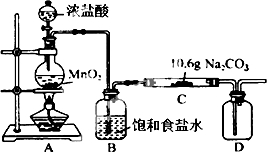 某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质.| 步骤 | 预期现象和结论 |
| 步骤1:取C中少量样品于试管中,滴加足量蒸馏水 至溶解,然后将所得溶液分别置于A、B试管中 | 固体物质全部完全溶解 |
| 步骤:向A试管中滴加适量BaCl溶液 | a. 如果 b. 如果 |
| 步骤: | 有白色沉淀生成,C的部分有NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com