
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |
| ||
| 106g/mol×0.5mol |
| 106g/mol×0.5mol+84g/mol×0.5mol |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
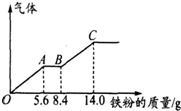 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、H2SO4浓度为2.5 mol?L-1 |
| B、第二份溶液中最终溶质为FeSO4 |
| C、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| D、原混合酸中NO3-物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、HClO的电子式:H:
| ||||||||
B、具有16个质子、16个中子和18个电子的微粒是
| ||||||||
C、邻羟基苯甲酸的结构简式: | ||||||||
D、乙烯的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据酸分子中含氢原子个数将酸分为一元酸、二元酸等 |
| B、根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 |
| C、根据元素原子最外层电子数的多少将元素分为金属和非金属 |
| D、根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com