
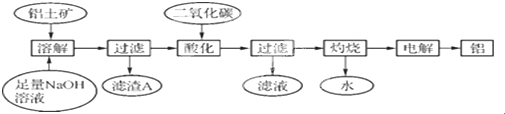


科目:高中化学 来源: 题型:
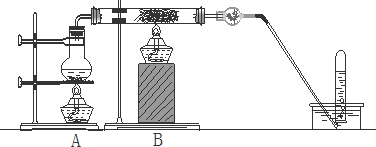
查看答案和解析>>
科目:高中化学 来源: 题型:
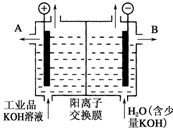 氢氧化钾是重要的工业产品.请回答:
氢氧化钾是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL溶液中含SO42-、Fe3+总数为NA |
| B、500mL溶液中含0.6NA个SO42- |
| C、1L溶液中含有0.2NA个Fe3+ |
| D、500mL该溶液中SO42-物质的量浓度为0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用pH试纸测定溶液的pH,应先将pH试纸湿润 |
| B、强酸溶液的导电性一定比弱酸溶液的导电性强 |
| C、SO2溶于水后,水溶液可导电,所以SO2是电解质 |
| D、离子化合物一定是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、分子式为C8H10的芳香烃有3个,分别为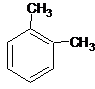 、 、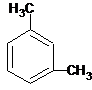 和 和 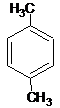 |
| B、分子式为C2H6O的同分异构体有两个,分别是 H3C-O-CH3 和 CH3CH2OH |
| C、分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3 |
D、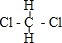 和 和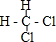 是两种不同的物质 是两种不同的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com