
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
分析 A.溶液颜色保持不变,可知浓度不变;
B.铬元素的含量为28.6g/L,+6价Cr的物质的量为$\frac{28.6g}{52g/mol}$=0.55mol,结合电子守恒计算;
C.常温下转化反应的平衡常数K=l04,则$\frac{\frac{10}{11}×0.55}{(\frac{1}{11}×0.55)^{2}×{c}^{2}({H}^{+})}$=l04,解得c(H+)=0.1mol/L;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,c(OH-)=$\root{3}{\frac{1×1{0}^{-32}}{1×1{0}^{-5}}}$=1×10-9mol/L,则c(H+)=1×10-5mol/L.
解答 解:A.溶液颜色保持不变,可知浓度不变,则上述可逆反应达到平衡状态,故A正确;
B.铬元素的含量为28.6g/L,+6价Cr的物质的量为$\frac{28.6g}{52g/mol}$=0.55mol,由电子守恒可知FeSO4•7H2O的质量为$\frac{0.55×(6-3)}{(3-2)}$mol×278g/mol=458.7g,故B错误;
C.常温下转化反应的平衡常数K=l04,则$\frac{\frac{10}{11}×0.55}{(\frac{1}{11}×0.55)^{2}×{c}^{2}({H}^{+})}$=l04,解得c(H+)=0.1mol/L,则转化后所得溶液的pH=1,故C正确;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,c(OH-)=$\root{3}{\frac{1×1{0}^{-32}}{1×1{0}^{-5}}}$=1×10-9mol/L,则c(H+)=1×10-5mol/L,则应调溶液的pH=5,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握电子守恒计算、溶度积的计算、平衡常数K的计算等为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
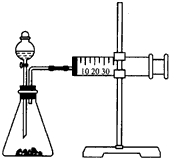 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
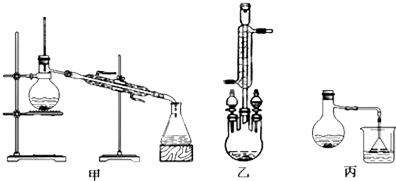
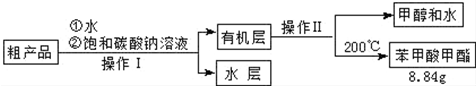
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
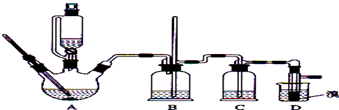
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
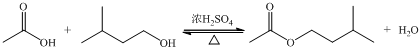
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
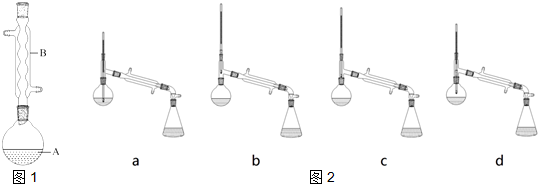
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
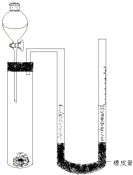 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com