
【题目】当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,须加入少量的( )
A.MgCl2B.NaOHC.MgSO4D.H2SO4
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是

A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2 min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量Q kJ。回答下列问题
(1)写出该反应的热化学方程式为______________________________________。
(2)在该条件下,反应前后容器的体积之比为______________。
(3)①若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)______0.5mol(填 “大于”、“小于”或“等于”);
②若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量_______Q kJ(填 “大于”、“小于”或“等于”)。
II. 用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

(1)A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B) (填 “﹥”、“<”或“﹦”)。
(2)A、B、C三点中NO2的转化率最高的是_____(填“A”或“B”或“C”)点。
(3)计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别取40 mL 0.50 mol/L盐酸与0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
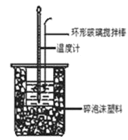
回答下列问题:假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。实验时,还需测量的数据有_______________。
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(2)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热为△H=____________。
(3)假定该学生的操作完全同上,实验中改用100 mL0.50 mol/L盐酸跟100 mL 0.55 mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”)所求中和热___________________(填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会__________(填“偏大”、“偏小”或“无影响”);用40 mL0.50 mol/LNaOH溶液进行上述实验,测得的中和热数值会__________。(填“偏大”、“偏小”或“无影响”)
(5)上述实验结果与57.3 kJ/mol(常温下中和热的值)有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
c.用量筒量取盐酸溶液的体积时仰视读数
d.分多次把NaOH溶液倒入盛有盐酸的小烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中同时存在![]() 和
和![]() 四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
物质 | 溶度积( |
|
|
|
|
|
|
|
|
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,![]() 几乎同时转化为沉淀
几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.![]() 时,四种金属离子全部以沉淀形式存在
时,四种金属离子全部以沉淀形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是

A. 放电时,电子由Ca电极流出
B. 放电过程中,Li+向PbSO4电极移动
C. 每转移0.2mol电子,理论上生成20.7 g Pb
D. 负极反应式:PbSO4+2e-+2Li+=Li2SO4+Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇可由乙烯气相直接水合法或间接水合法生产,一些转化如图:


回答以下问题:
(1)间接水合法中的转化③:乙烯与浓硫酸反应生成硫酸氢乙酯(CH3CH2OSO3H)的有机反应类型是____,转化④的化学方程式是_____。
(2)蘸有B的玻璃棒遇到氮的最简单氢化物气体会冒白烟,反应的化学方程式为_________,转化⑤的化学方程式为____________。
(3)将一质量为w的铜丝灼烧变黑后,迅速插入乙醇中,变黑的铜丝恢复红色。该反应的化学方程式为_____。
(4)已知:CH3CHO+NaHSO3→![]() ↓(α﹣羟基乙磺酸钠),所得乙醛可用如图方式提纯:
↓(α﹣羟基乙磺酸钠),所得乙醛可用如图方式提纯:

①乙醛晶体类型为__________。
②分离操作A的名称是____;
③某同学设计分离操作B的装置(夹持和加热装置已略去)如图所示。冷凝管中的液体应从_____口进。(填“D”或“E”),下列有关操作与装置的分析,正确的是_____(填字母,多选反扣)。
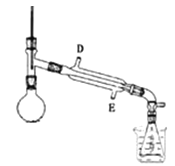
A.烧杯中应装冰水
B.冷凝管应通温水
C.如图示装置可用于除去乙酸乙酯中混有的乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com