
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
分析 A.氢硫酸的电离程度较小,主要以第一步为主,则溶液中c(H2S)最大,其次为c(H+),c(OH-)最小;
B.根据亚硫酸氢钠溶液中的电荷守恒判断;
C.根据混合液中的物料守恒判断;
D.该溶液中氢氧根离子浓度为10-2mol/L,氢离子浓度为10-12mol/L,根据质子守恒计算.
解答 解:A.0.01mol•L-1H2S溶液中,硫化氢为二元弱酸,其电离程度较小,主要以第一步为主,则:c(H2S)最大,其次为c(H+),c(OH-)最小,溶液中正确的浓度大小为:c(H2S)>c(H+)>c(HS-)>c(S2-)>c(OH-),故A错误;
B.根据NaHSO3溶液中的电荷守恒可得:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),则c(Na+)+c(H+)>c(HSO3-)+c(SO32-)+c(OH-),故B错误;
C.等物质的量的NH4Cl和NaCl的混合溶液中,根据物料守恒可得:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-),故C正确;
D.该溶液中氢氧根离子浓度为10-2mol/L,氢离子浓度为10-12mol/L,根据质子守恒可得:c(HCO3-)+2c(H2CO3)+c(H+)=c(OH-),则c(HCO3-)+2c(H2CO3)=c(OH-)-c(H+)=c(10-2-10-12) mol•L-1,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、质子守恒的含义及其应用为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
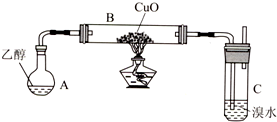
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
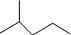 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.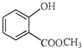 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.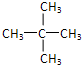 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  聚乙烯盒 |  |
| 成分 | (NH4)2SO4 | Na2CO3 | 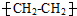 | Fe2O3 |
| 用途 | 化肥 | 制玻璃 | 盛放食品 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
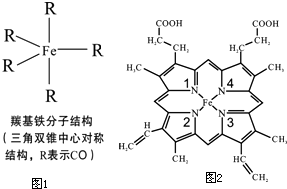 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
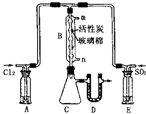 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
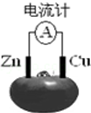
| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com