
在V mL Al2(SO4)3溶液中含有Al3+m g,取V/4 mL该溶液用水稀释至4V mL,则SO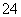 物质的量浓度为 ( )
物质的量浓度为 ( )
A.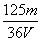 mol/L B.
mol/L B.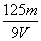 mol/L C.
mol/L C.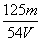 mol/L D.
mol/L D.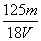 mol/L
mol/L
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X元素原子半径是所有元素原子中最小的,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子序数为24。请回答下列问题。
(1)Y、Z、W的第一电离能由小到大的顺序为________。
(2)J原子的核外电子排布式为___________________________ _____________________________________________。
(3)Y2X2分子中Y原子轨道的杂化类型为________。1 mol Y2X2分子中含有σ键与π键的数目之比为____________________________ ____________________________________________。
(4)Z与W形成的一种Z2W分子,与该分子互为等电子体的阴离子为________(任写一种)。
(5)JCl3能与Z、W的氢化物形成配位数为6的络合物,且相应两种配体的物质的量之比为2:1,氯离子全部位于外界。则该配合物的化学式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①参加反应的物质的性质是影响化学反应速率的主要因素
② 光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度
光是影响某些化学反应速率的外界条件之一 ③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度、加热、加压、使用催化剂都可以加快反应速率
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,将1 mol N2O4充入体积为1 L的密闭容器中,反应3 s
后,NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是 ( )
A .150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
C.150 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
完全中和50ml物质的量浓度为2mol/LnaOH
溶液需要H2SO4的质量是多少?若将这些H2SO4溶于水配成500ml溶液,求H2SO4的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
相对分子质量为Mr的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为ρ g/mL,则该饱和溶液中溶质的物质的量浓度是( )
A.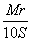 mol·L-1 B.
mol·L-1 B.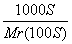 mol·L-1
mol·L-1
C.10Sρ/Mr mol·L-1 D.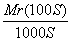 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积,请回答以下问题。
该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用________(填仪器名称并注明规格)量取7.5mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100 mL 1.0 mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小(填写字母) 。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯中有少量水
(2)请填写操作步骤中的空格:步骤②_______________ 步骤③___________
(3)实验步骤⑤中应选用__________(填字母)的量筒。
A.100 mL B.200 mL C.500 mL
(4)读数时除恢复到室温外,还要注意
①______________________________,②_________________________________。
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____L/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:t ℃时,2H(g)+Y(g)2I(g) ΔH=-196.6 kJ·mol-1,t ℃时,在一压强恒定的密闭
容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol
气态的I物 质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为 ( )
质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为 ( )
A.0.8 mol B.0.6 mol C.0.5 mol D.0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com