
【题目】298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。下列叙述正确的是( )
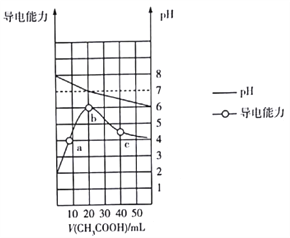
A. MOH是强电解质 B. b点对应的盐不水解
C. 水的离子积Kw:b>c>a D. c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】某同学用托盘天平称量镁粉25.3g(1g以下用游码),他把镁粉放在右盘,当天平平衡时,所称取的镁粉的实际质量是( )
A.25.2gB.24.8gC.24.7gD.25.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp [Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)= 1.8×10-5,下列叙述不正确的是
A. Mg(OH)2、Fe(OH)3的饱和溶液中c(OH-)的大小顺序:Mg(OH)2>Fe(OH)3,25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀,
B. 25℃时,加大量水稀释氨水,电离程度增大,溶液pH减小
C. 25℃时,NH4++H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
D. 将0.02 molL-1MgCl2溶液和0.02 molL-1NaOH溶液等体积混合,没有沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是( )
A. CH4与NH3 B. C2H6与C2H4
C. H2与Cl2 D. Cl2与N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行可逆反应:A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是( )
A.容器内气体的压强
B.混合气体的总物质的量
C.A的物质的量浓度
D.混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素③的原子结构示意图______;元素⑨形成的氢化物的电子式___________。
(3)表中元素④、⑨形成的氢化物的稳定性顺序为_____> (填化学式)。
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____> (填化学式)。
(5)表中元素③、④、⑥、⑦的原子半径大小为____> > > (填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.钠保存在煤油里的原因之一是它的密度比煤油大B.铝在空气中很容易燃烧
C.镁表面的氧化膜疏松,不能保护内层金属D.铁锈的主要成分是Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用下图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系
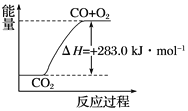
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3<HClO<HF
B. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
C. 若将CO2通入0.lmol/LNa2C03溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
D. 向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com