
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1b.+29.7 mol·L-1
c.-20.6 mol·L-1d.-241.8 kJ·mol-1
【答案】O 第三周期第ⅢA族 Al>C>N>O>H ![]()
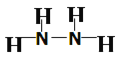 34 H2SeO4 b
34 H2SeO4 b
【解析】
X、Y、Z、L的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,所以X、Y、Z、L分别是H、C、N、O元素;M是地壳中含量最高的金属元素,所以M是Al元素;
(1) L的元素符号为O元素;M在元素周期表中的位置为第三周期第ⅢA族;五种元素的原子半径从大到小的顺序是Al>C>N>O>H;
(2) Z、X两元素按原子数目比l∶3和2∶4构成分子NH3和N2H4,NH3的电子式为![]() ,B的 结构式为
,B的 结构式为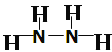 ;
;
(3) 硒Se原子比O原子多两个电子层,则Se的原子序数为34,其最高价为+6,最高价氧化物对应的水化物化学式为H2SeO4。非金属性越强越易与氢气化合,生成1 mol硒化氢反应热的是+29.7 mol·L-1。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示,下列说法不正确的是
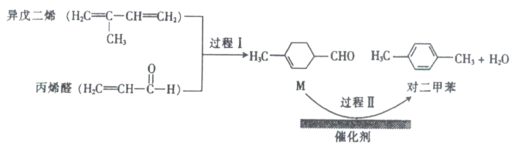
A.异戊二烯所有碳原子可能共平面
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物有2种
D.M具有芳香族同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述放热反应,X(g)+Y(g)![]() 2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的( )
![]()
A. 反应速率:v(B)>v(A) B. A容器中X的转化率为80%
C. 平衡时的压强:PB>2PA D. 平衡时Y体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
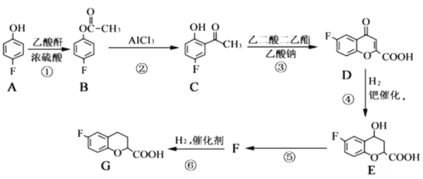
已知:乙酸酐的结构简式为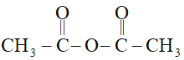
请回答下列问题:
(1)A的名称是__________;B中所含官能团的名称是__________。
(2)反应⑤的化学方程式为__________________,该反应的反应类型是______________。
(3)G的分子式为________________,乙酸酐共面的原子最多有_________个。
(4)写出同时满足下列条件的E的同分异构体的结构简式:________________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.![]() 该物质与足量
该物质与足量![]() 溶液反应生成
溶液反应生成![]()
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
的合成路线流程图(无机试剂任选),合成路线流程图示例如下:
![]()
__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
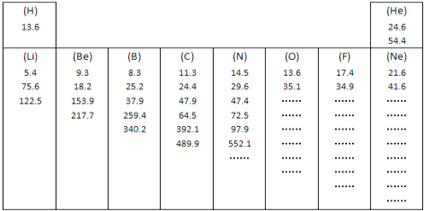
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____(填序号),易溶于水的有_____(填序号),理由是:____________。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________,说明N2中________键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:
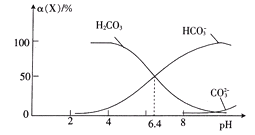
下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。某研究小组欲用以下三种方案制备ClO2,回答下列问题:
(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
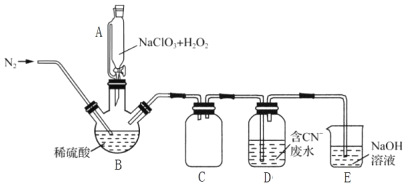
①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
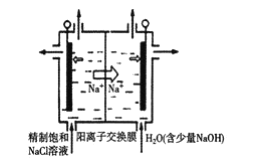
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.已知甲池的总反应式为: 2CH3OH+3O2+4KOH![]()
![]() 2K2CO3+6H2O
2K2CO3+6H2O
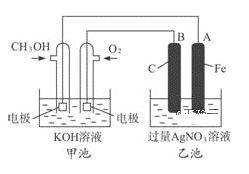
请填空:
(1)充电时:①燃料电池的正极与电源______极相连.
②阳极的电极反应式为__________________________________.
(2)放电时:负极的电极反应式为______________________________.
(3)在此过程中若完全反应,乙池中A极的质量增加324g,则甲池中理论上消耗O2______L(标准状况下).
(4)工业上用3克氢气与足量二氧化碳反应生成气态甲醇(CH3OH)和水蒸气,放出24.5千焦的热量,请写出该反应的热化学反应方程式:_________________________.
(5)用该电池为电源电解氯化镁制取金属镁,消耗甲醇1.6g,可制得金属镁______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com