��2011?ɽ��ģ�⣩ij�о���ѧϰС���������ռ���������Ϣ���ء��ơ��ơ�þ�Ȼ��ý���������CO
2������ȼ�գ����Ƕ�����CO
2������ȼ�պ�IJ����еİ�ɫ���ʽ���������̽����
��ʵ�顿��ȼ�յ���Ѹ�����뵽ʢ��װ��CO
2�ļ���ƿ�У��������м���ȼ�գ���Ӧ����ȴ��ƿ���ź�ɫ������ƿ����ճ���Ű�ɫ���ʣ�
��1��ͨ������CO
2������ȼ�յ�ʵ�飬����Ϊȼ�յ�������
һ��Ҫ�п�ȼ����ڣ�����Ҫ����ȼ����ڣ����ǿ�ȼ�����ﵽ�Ż��
һ��Ҫ�п�ȼ����ڣ�����Ҫ����ȼ����ڣ����ǿ�ȼ�����ﵽ�Ż��
��
��2��ȼ�յı�����
���⡢���ȵľ��ҵ�������ԭ��Ӧ
���⡢���ȵľ��ҵ�������ԭ��Ӧ
��
��3��2010��8�³������Ķ���˹ɭ�ִ���б����л�Ҫ������������ɭ�ֻ��������������⣮����ȼ�յ��������������Ϊʲô����ɭ�ַ�����������Ч��ֹɭ�ֻ��ֵ����ӣ�
����ɭ�ַ���������������ȼ�յ�����֮һ--��ȼ��Ĵ���
����ɭ�ַ���������������ȼ�յ�����֮һ--��ȼ��Ĵ���
��
��������衿����1����ɫ������Na
2O��
����2����ɫ������Na
2CO
3��
����3����ɫ������Na
2O��Na
2CO
3�Ļ���
�����ʵ�鷽������֤���衿��С���ȼ�պ�İ�ɫ�����������̽����
| ʵ�鷽�� |
ʵ����� |
ʵ������ |
���� |
| ����1 |
ȡ������ɫ�������Թ��У���������ˮ������Ʒȫ������ˮ�������м�����ɫ��̪��Һ |
��Һ��ɺ�ɫ |
��ɫ����ΪNa2O |
| ����2 |
��ȡ������ɫ�������Թ��У���������ˮ������Ʒȫ������ˮ�������м��������CaCl2��Һ |
���ְ�ɫ���� |
|
| �۾���Ƭ�̣�ȡ�ϲ���Һ���Թ��У��μ���ɫ��̪��Һ |
���������� |
��˼���뽻����
��4����ͬѧ��Ϊ����1�õ��Ľ��۲���ȷ����������
Na2CO3��Һ�Լ��ԣ�Ҳ��ʹ��̪���
Na2CO3��Һ�Լ��ԣ�Ҳ��ʹ��̪���
��
��5����ͬѧ��Ϊ����2�õ��Ľ�����ȷ����ɫ����Ϊ
Na2CO3
Na2CO3
��
��6��ͨ������1�ͷ���2��ʵ�飬����Ϊ�������������У�
����2
����2
���������������
����2���г��ֵİ�ɫ������CaCO3������ȼ�պ�İ�ɫ��������Na2CO3���ڣ�����2���еμ���ɫ��̪��Һ����������˵��ȼ�պ�İ�ɫ������û��Na2O����
����2���г��ֵİ�ɫ������CaCO3������ȼ�պ�İ�ɫ��������Na2CO3���ڣ�����2���еμ���ɫ��̪��Һ����������˵��ȼ�պ�İ�ɫ������û��Na2O����
��
��7�����ڶ�����̼��ȼ�յĻ�ѧ����ʽΪ
��
��8����ͬѧ��Ϊ��ɫ�����п������������ƣ����Ƿ�ͬ���ͬѧ�Ĺ۵㣬���������ɣ�
��ͬ�⣻��Ϊ��Ӧ��������Ԫ�أ���Υ�������غ㶨�ɣ�
��ͬ�⣻��Ϊ��Ӧ��������Ԫ�أ���Υ�������غ㶨�ɣ�
��

 ��2011?ɽ��ģ�⣩��ȩ����Ҫ���л��ϳ�ԭ�ϣ���������������֬���ϳ���ά��ҩ�Ϳ�ϵȣ�Ҳ������������֯��WHO��ȷ�ϵ��°�����»�����֮һ�����й����ڻ�������ίԱ�����ͳ�ƣ��й���װ��ͥ��ȩ����60%���ϣ��ҹ��涨���ڿ����м�ȩ�������ó���0.08mg/m3��
��2011?ɽ��ģ�⣩��ȩ����Ҫ���л��ϳ�ԭ�ϣ���������������֬���ϳ���ά��ҩ�Ϳ�ϵȣ�Ҳ������������֯��WHO��ȷ�ϵ��°�����»�����֮һ�����й����ڻ�������ίԱ�����ͳ�ƣ��й���װ��ͥ��ȩ����60%���ϣ��ҹ��涨���ڿ����м�ȩ�������ó���0.08mg/m3��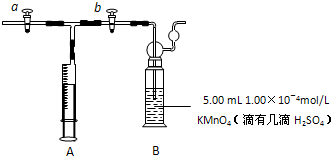



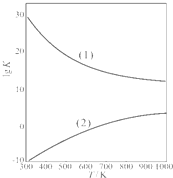
 ��2011?ɽ��ģ�⣩A��B��C��D��E��F�������ʵ��ת����ϵ��ͼ��ʾ����Ӧ����δ����������з�Ӧ�����û���Ӧ��
��2011?ɽ��ģ�⣩A��B��C��D��E��F�������ʵ��ת����ϵ��ͼ��ʾ����Ӧ����δ����������з�Ӧ�����û���Ӧ��

 ��2011?ɽ��ģ�⣩[��ѧ-ѡ���л���ѧ����]
��2011?ɽ��ģ�⣩[��ѧ-ѡ���л���ѧ����]




 ��2011?ɽ��ģ�⣩��ɣ��׳�������й�����������Ʒ��֮һ��ijͬѧ�������·��������Բⶨ��ͼ��ʾ�����ƿ���ݻ�����32.76g NaCl������뵽500ml�ձ��У�����200ml����ˮ����NaCl��ȫ�ܽ����Һȫ��ת�Ƶ���ƿ�У�������ˮϡ������ȫ��������������ȡ��100ml��Һ������Һǡ������10ml��0.100mol/L��AgNO3��Һ��ȫ��Ӧ��������˵����ȷ���ǣ�������
��2011?ɽ��ģ�⣩��ɣ��׳�������й�����������Ʒ��֮һ��ijͬѧ�������·��������Բⶨ��ͼ��ʾ�����ƿ���ݻ�����32.76g NaCl������뵽500ml�ձ��У�����200ml����ˮ����NaCl��ȫ�ܽ����Һȫ��ת�Ƶ���ƿ�У�������ˮϡ������ȫ��������������ȡ��100ml��Һ������Һǡ������10ml��0.100mol/L��AgNO3��Һ��ȫ��Ӧ��������˵����ȷ���ǣ�������