
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
分析 A.根据碳酸氢钠溶液中的电荷守恒判断;
B.根据硫化钠溶液中的物料守恒分析;
C.钠离子和硫酸根离子都不水解,则:[Na+]=[SO42-];
D.恰好反应生成乙酸钠,钠离子部分水解,溶液显示碱性,则[Na+]>[CH3COO-]、[H+]<[OH-]
解答 解:A.0.1 mol•L-1 NaHCO3溶液中,根据电荷守恒可知:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-],故A正确;
B.0.1 mol•L-1Na2S溶液中,根据物料守恒可得:[Na+]═2[S2-]+2[HS-]+2[H2S],故B错误;
C.0.1 mol•L-1 NaHSO4溶液中,根据物料守恒可知:[Na+]=[SO42-],氢离子还来自水的电离,则:[H+]>[Na+]=[SO42-],正确的离子浓度大小为:[H+]>[Na+]=[SO42-]>[OH-],故C错误;
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后,恰好反应生成乙酸钠,钠离子部分水解,溶液显示碱性,则[Na+]>[CH3COO-]、[H+]<[OH-],正确的离子浓度大小为:[Na+]>[CH3COO-]>[OH-]>[H+],故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理原理的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
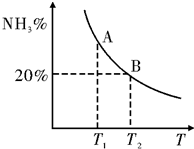 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率% $\frac{n(N{H}_{3})}{n(C{O}_{2})}$ | 100 | 150 | 200 |
| 1 | 19.6 | 27.1 | 36.6 |
| 1.5 | a | b | c |
| 2 | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中,只存在离子键,不可能存在其它化学键 | |
| B. | 氧族元素(O、S、Se、Te)的氢化物的沸点依次升高 | |
| C. | NaHSO4、Na2O2晶体中的阴阳离子个数比均为1:1 | |
| D. | 晶体的硬度:金刚石>碳化硅>石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
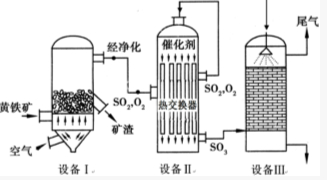 以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:(1)依据工艺流程图判断下列说法不正确的是(选填序号字母)DF.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+O2↑ | |
| B. | 氯化铁溶液和氢氧化钠溶液反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| B. | 氯化铝中加入氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸铜与氢氧化钡溶液反应:Cu2++SO42-+Ba2++2OH-═Cu(OH)2↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NH4Cl | B. | 0.1 mol N2 | ||
| C. | 1.204×1022个CO(NH2)2 | D. | 0.2mol NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com