

分析 探究铁和硫反应产物实验流程:为防止Fe和S被氧气氧化,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,S粉必须要过量,保证铁粉完全反应,避免过量的铁粉与硫酸反应生成Fe2+而干扰实验,在黑色固体中加入热的氢氧化钾溶液,发生反应:3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,将稀硫酸煮沸防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验,取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.
如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁.
(1)混合粉末A中S粉必须要过量,保证铁粉完全反应,防止在操作③中过量的铁粉与硫酸反应生成+2价的铁干扰实验产物的检验;
(2)铁能和氧气反应生成四氧化三铁,硫和氧气反应生成二氧化硫,反应在“惰性气体环境中”进行防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验;
(3)操作①是用烧热的玻璃棒点触,该发应能持续进行,说明该反应为放热反应;
(4)硫和热碱反应生成水和易溶于水的硫化钾和亚硫酸钾;
(5)氧气能氧化亚铁离子,操作③中稀硫酸煮沸的目的排除氧气的干扰;
(6)利用+3价的铁和硫氰根离子络合生成血红色的硫氰化铁检验+3价的铁,利用+2价的铁能使高锰酸根离子褪色检验+2价铁,据此设计实验.
解答 解:(1)实验目的:探究铁和硫反应产物中铁的化合价为+2价或+3价或既有+2也有+3价,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,如果铁粉过量,过量的铁粉与硫酸反应生成Fe2+而干扰实验产物的检验,所以混合粉末A中S粉必须要过量,
故答案为:过量的铁粉与操作③中的反应生成Fe2+而干扰实验验;
(2)四氧化三铁为黑色固体,铁能和氧气反应生成四氧化三铁,硫和氧气反应生成二氧化硫,混合粉末A中S粉反应在“惰性气体环境中”进行防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验,
故答案为:防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验;
(3)因硫和铁粉反应是放热反应,所以用烧热的玻璃棒点触,该发应能持续进行,
故答案为:硫和铁粉反应是放热反应;
(4)在黑色固体中加入热的氢氧化钾溶液,发生反应:3S+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2S+K2SO3+3H2O,除去混合物中过量的硫粉,
故答案为:除去混合物中过量的硫粉;
(5)操作③中稀硫酸煮沸,排出溶解在其中的氧气,防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验,
故答案为:防止硫酸中溶解的O2将前面反应过程中可能生成的Fe2+氧化而干扰实验;
(6)+3价的铁和硫氰根离子络合生成血红色的硫氰化铁,+2价的铁能使高锰酸根离子褪色,取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁,
故答案为:取少量的D溶液于两支小试管中,向第一支试管中滴加少量KSCN溶液,向第二支试管中滴加少量酸性高锰酸钾溶液.如果第一支试管出现血红色,而第二支试管高锰酸钾紫红色不褪去,说明铁和硫反应只生成三价铁;如果第一支试管不变血红色,而第二支试管高锰酸钾紫红色褪去,说明只生成亚铁;如果第一支试管变血红色,第二支试管紫红色也褪去,说明既生成了三价铁也生成了亚铁.
点评 本题考查了铁和硫反应产物的探究,侧重于离子的检验的考查,注意掌握铁、硫及其化合物的性质以及常见物质的检验方法,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:解答题
| B | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是反应物总能量大于生成物的总能量 | |
| B. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| C. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| B. | 一束可见光透过胶体时,有丁达尔效应产生 | |
| C. | 胶体属于混合物 | |
| D. | 氢氧化铁胶体能吸附水中的悬浮颗粒并沉淀,因此常用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.6g | B. | 6g | C. | 4.8g | D. | 2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
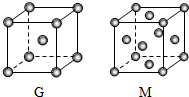 A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.
A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大.其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:3 | B. | 2:3 | C. | 10:3 | D. | 3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com