
【题目】以芳香化合物A为原料制备灭鼠剂氟鼠酮中间体(G)的一种合成路线如下:

回答下列问题:
(1)A的化学名称是________;A→B的试剂及反应条件依次是________。
(2)E→F的反应类型是________。
(3)D的结构简式为________。
(4)G中的含氧官能团名称为________。
(5)芳香化合物X是F的同分异构体,X能发生银镜反应和水解反应,核磁共振氢谱有4组峰且峰面积之比为6︰6︰1︰1,写出一种符合上述条件的X的结构简式:________。
(6)PES(聚丁二酸乙二醇酯)是一种可生物降解型聚酯,设计以1,2-二氯乙烷为初始原料制备PES的合成路线:________(无机试剂任用)。
【答案】甲苯 Cl2,光照 取代反应 ![]() 羟基、酯基和醚键
羟基、酯基和醚键 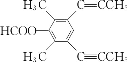 或
或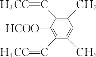
【解析】
由题干信息可以推出:A: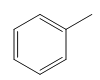 B:
B: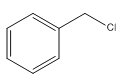 C:
C: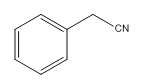 D:
D: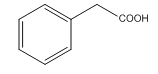 E:
E: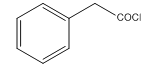 。
。
(1)A: ,化学名称是甲苯;A:
,化学名称是甲苯;A: B:
B: 取代的是甲基上的氢原子,故试剂及反应条件依次是Cl2,光照;
取代的是甲基上的氢原子,故试剂及反应条件依次是Cl2,光照;
(2)E: 断C-Cl键,剩下的带苯环的结构取代苯甲醚中醚键对位上的氢原子,故E→F的反应类型是取代反应;
断C-Cl键,剩下的带苯环的结构取代苯甲醚中醚键对位上的氢原子,故E→F的反应类型是取代反应;
(3)由分析可知,D的结构简式为 ;
;
(4)芳香化合物X是F的同分异构体,X能发生银镜反应和水解反应,核磁共振氢谱有4组峰且峰面积之比为6︰6︰1︰1,分析一下限定条件:“峰面积之比为6︰6”应该分别是两个甲基对称等效,“X能发生银镜反应和水解反应”说明是甲酸酯。则X的结构简式为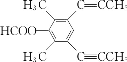 或
或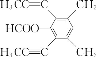 ;
;
(6)先以1,2-二氯乙烷分别合成丁二酸和乙二醇,丁二酸的合成参照B→D增碳链的方法。最后丁二酸和乙二醇发生缩聚反应生成聚丁二酸乙二醇酯,合成的路线为:
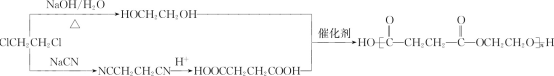 。
。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)已知:C(s)+O2(g)![]() CO2(g) △H=-393.5kJ/mol
CO2(g) △H=-393.5kJ/mol
N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
则C(s)+2NO(g)![]() CO2(g)+N2(g)的△H=___________ kJ/mol
CO2(g)+N2(g)的△H=___________ kJ/mol
(2)用焦炭还原NO2的反应为2 C(s)+2NO2(g)![]() N2(g)+2CO2(g),向两个容积均为2L、反应温度分别为T1℃、T2℃的恒温恒容密闭容器中分别加入足量的焦炭和一定量的NO2,测得各容器中n(NO2)随反应时间t的变化情况如图所示;
N2(g)+2CO2(g),向两个容积均为2L、反应温度分别为T1℃、T2℃的恒温恒容密闭容器中分别加入足量的焦炭和一定量的NO2,测得各容器中n(NO2)随反应时间t的变化情况如图所示;
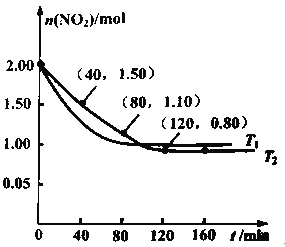
①T1___________T2(填“>”或“<”),该反应为___________(填“放热”或“吸热”)反应。
②T2℃时,40~80min,用N2的浓度变化表示的平均反应速率为v(N2)=___________,此温度下的化学平衡常数K=___________。
③T2℃下,120min时,向容器中再加入焦炭和NO2各1mol,在t时刻达到平衡时,NO2的转化率比原平衡时___________(填“增大”、“减小”或“不变”)。
(3)工业上消除氮氧化物的常用方法是SCR(选择性催化还原)脱硝法,反应原理为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
①SCR法除NO,投料比一定时有利于提高NO平衡转化率的反应条件是___________、___________。
当反应温度过高时,会发生以下副反应:2NH3(g)+2O2(g)![]() N2O(g)+3H2O(g);4NH3(g)+5O2(g)
N2O(g)+3H2O(g);4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
②某科研小组通过系列实验,分析得出脱硝率与氨氮比[ NH3/NOx表示氨氮比]、温度的关系如图所示,从图一可以看出,最佳氨氮比为2.0,理由是______________________;由图二可知,当温度高于405℃后,脱硝率会逐渐减小,原因是______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 保持容器体积不变,通入稀有气体增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=(c2-c1)/(t2-t1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中过量的氨氮(NH3和NH4+)会导致水体富营养化。某科研小组用NaClO氧化法处理氨氮废水。已知:①HClO的氧化性比NaClO强;②NH3比NH4+更易被氧化;③国家标准要求经处理过的氨氮废水pH要控制在6~9。
(1)pH=1.25时,NaClO可与NH4+反应生成N2等无污染物质,该反应的离子方程式为_____。
(2)进水pH对氨氮去除率和出水pH的影响如下图所示

①进水pH为1.25~2.75范围内,氨氮去除率随pH升高迅速下降的原因是_____
②进水pH为2.75~6.00范围内,氨氮去除率随pH升高而上升的原因是_____
③进水pH应控制在_____左右为宜。
(3)为研究空气对NaClO氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是_____(填字母)。
a.O2的氧化性比NaClO弱 b.O2氧化氨氮速率比NaClO慢
c.O2在溶液中溶解度比较小 d.空气中的N2进入溶液中
(4)利用微生物燃料电池可以对氨氮废水进行处理,其装置如图所示。闭合电路后,负极室与正极室均产生氮气,则负极室中NH4+发生反应的电极反应式为_____。该装置除了能对氨氮废水进行处理外,另一个突出的优点是_____。
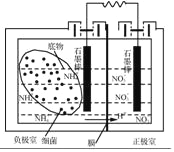
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、铁及其化合物用途非常广泛。回答下列问题:
(1)基态S原子价电子排布式为________,基态Fe原子未成对电子数为________个。
(2)团簇 中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
中,S、C、N的化合价依次为-2、+2、-3,Fe2+与Fe3+数目之比为________;与铁形成配位键的原子是________。
(3)工业上主要通过反应SO3+SCl2=SOCl2+SO2制备SOCl2(氯化亚砜),上述四种分子中,属于非极性分子的是________;SCl2分子空间构型为________形;SOCl2分子中心原子杂化方式是________。
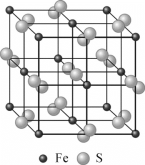
(4)黄铁矿的晶体结构如图所示,已知黄铁矿晶胞参数为a=0.5417nm,阿伏加德罗常数的值为NA。则黄铁矿的密度为________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+
C. 氢氧化镁溶于盐酸:Mg(OH)2+H+=Mg2++H2O
D. Cu(OH)2与稀硫酸反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是
A. 垃圾分类中可回收物标志:![]()
B. 农谚“雷雨肥庄稼”中固氮过程属于人工固氮
C. 绿色化学要求从源头上减少和消除工业生产对环境的污染
D. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):_____________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是________,能“吃掉”盐酸的氧化物有________.
(3)在不能与盐酸反应的物质中,属于氧化物的是______(填写物质序号,下同),属于单质的是____。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么? _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com