
下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列说法中正确的是
A.标准状况下,11.2 L N2和17 g NH3中所含有的N原子数相同
B.9 g H2O和0.5 mol O2中含的原子数相同
C.20℃时,相同体积的N2、O2一定含有相同的分子数
D.在常温常压下,20 mL CH4与60 mL O2所含的原子个数比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol/L的HCl溶液,恰好使混合物完全溶解,
 所得溶液中加入KSCN溶液后无红色出现,若用过量的CO在高温下还原相同质量的此混合物,固体的质
所得溶液中加入KSCN溶液后无红色出现,若用过量的CO在高温下还原相同质量的此混合物,固体的质
量减少了 ( )
A.6.4 g B.4.8 g C.2.4 g D.1.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铁及其化合物的说法中正确的是( )
A.磁铁矿的主要成分是Fe2O3
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加过量铁粉,然后过滤
D.Fe3+与KSCN反应产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
A.Fe与Al 的物质的量之比为1:1
B.混合气体中NO为0.03mol ,N2O为0.12mol
C.原HNO3溶液的浓度C=4 .9mol/L
.9mol/L
D.反应中被还原的HNO3为0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碳和硅的叙述中,正确的是( )
A.其氧化物都能与NaOH溶液反应
B.其单质在加热时都能跟O2反应
C.其氧化物都能溶于水生成相应的酸
D.碳和硅两种 元素共有两种单质
元素共有两种单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下某无色混合气体可能由CH4、NH3 、H
、H 2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减少,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成分是
2、CO、CO2和HCl中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓H2SO4时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减少,把剩余气体导出后,在O2中能够点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成分是
A.CH4和NH3 B.HCl、H2和CO
C.HCl和CO  D.HCl、CO和CO2
D.HCl、CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈 紫色。
紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是_____________,此液体具有的性质是________(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为____________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸该酸的某盐常用于实验室制取氧气的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转 移时,该反应的化学方程式是_______________。
移时,该反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
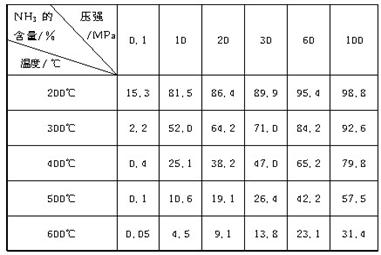
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com