

分析 X、Y、Z、W、M、N 为原子序数依次增大的六种短周期元素,在周期表中X是原子半径最小的元素,则X为H元素;X与M同主族,结合原子序数可知M为Na;Y、Z、W的原子序数小于M,处于第二周期,X能与Y、Z、W分别形成电子数相等的三种分子,考虑10电子分子,Z、W的最外层电子数之和与M的核外电子总数相等,W与N同主族,且常温下六种元素的常见单质中三种为气体、三种为固体,故Z最外层电子数为5、W最外层电子数为6,可推知Y为C、Z为N、W为O,N为S元素,据此解答.
解答 解:X、Y、Z、W、M、N 为原子序数依次增大的六种短周期元素,在周期表中X是原子半径最小的元素,则X为H元素;X与M同主族,结合原子序数可知M为Na;Y、Z、W的原子序数小于M,处于第二周期,X能与Y、Z、W分别形成电子数相等的三种分子,考虑10电子分子,Z、W的最外层电子数之和与M的核外电子总数相等,W与N同主族,且常温下六种元素的常见单质中三种为气体、三种为固体,故Z最外层电子数为5、W最外层电子数为6,可推知Y为C、Z为N、W为O,N为S元素.
(1)N为S元素,位于周期表中第三周期VIA族,非金属性Y(C)<W(O),故Y的氢化物稳定性<W的氢化物稳定性,
故答案为:第三周期VIA族;<;
(2)X、Z 形成的含18电子的化合物为N2H4,电子式为 ,
,
故答案为: ;
;
(3)由H、N、O、S四种元素组成的一种离子化合物A,A既能与盐酸反应,又能与氯水反应,则A为NH4HSO3或(NH4)2SO3,A与足量盐酸反应的离子方程式为:HSO3-+H+=SO2↑+H2O或SO32-+2H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O或SO32-+2H+=SO2↑+H2O;
(4)H和O组成的化合物中,既含有极性共价键又含有非极性共价键的是H2O2,此化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨气,相应的离子方程式为:OH-+CN-+H2O2=CO32-+NH3↑,
故答案为:H2O2;OH-+CN-+H2O2=CO32-+NH3↑.
点评 本题综合考查位置结构性质关系,明确元素的种类为解答该题的关键,侧重对知识的迁移应用,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
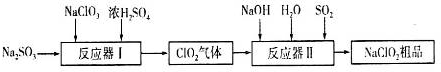
 ):
):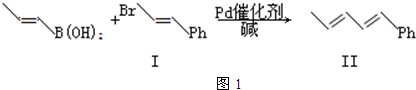
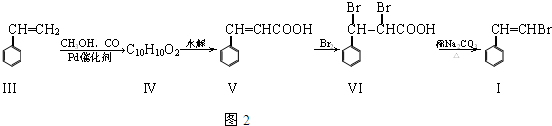
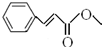 ;
; .
.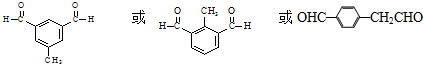 .
.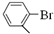 )与化合物【
)与化合物【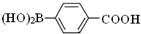 】也能发生类似反应①的偶联反应,写出产物的结构简式
】也能发生类似反应①的偶联反应,写出产物的结构简式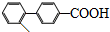 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以地沟油为原料加工制成的生物柴油的成分与从石油分馏得到的柴油成分不同 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱性溶液中:Na+、Cl-、K+、SO42- | |
| D. | 在强酸性溶液中:K+、Fe2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
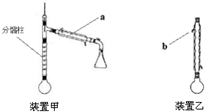 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: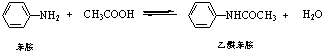
| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
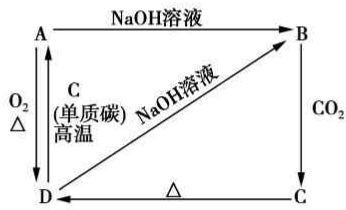 已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.
已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
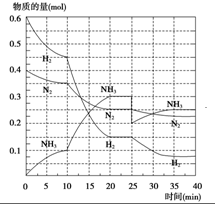 氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)高温、高压催化剂查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com