
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 明矾净水过程中涉及化学变化 | |
| C. | Fe(OH)3胶体与食盐溶液混合将产生聚沉观象 | |
| D. | 沸水中滴加适量饱和FeCl3溶液,可形成带正电荷的胶体 |
分析 A.江河入海口三角洲的形成是由于胶体的聚沉;
B.明矾净水是因为明矾电离生成的铝离子水解生成新物质氢氧化铝胶体具有吸附性;
C.胶体遇电解质发生聚沉;
D.胶体是电中性的分散系.
解答 解:A.江河水中的细小泥沙是胶体,遇到海水中的电解质发生了聚沉,日积月累,形成了三角洲,故A正确;
B.明矾净水过程有新物质氢氧化铝胶体生成,属于化学变化,故B正确;
C.Fe(OH)3胶体与食盐溶液发生聚沉生成沉淀氢氧化铁,故C正确;
D.沸水中滴加适量饱和FeCl3溶液加热至红褐色液体为氢氧化铁胶体,氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,故D错误.
故选D.
点评 本题考查胶体性质,胶体具有吸附性、丁达尔效应,聚沉,知道氢氧化铁胶体制备方法,难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 长颈漏斗 | B. | 分液漏斗 | C. | 圆底烧瓶 | D. | 蒸馏烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
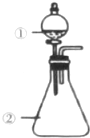 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和O2 | B. | H2和HCl | C. | H2S和HCl | D. | Cl2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
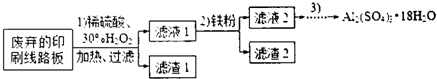
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
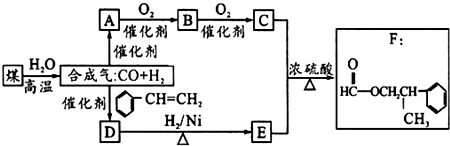
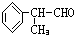
 .
. 、
、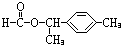 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
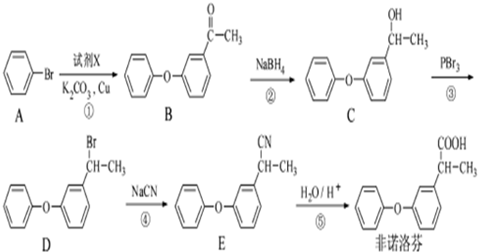
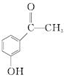 .
.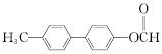 .
.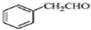 为原料制备
为原料制备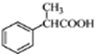 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com