
| A. | ②④ | B. | ②③ | C. | ③④ | D. | ①④ |
分析 ①阴离子可能有氧化性;
②有电子转移的化学反应是氧化还原反应;
③1mol Cl2参加反应转移电子数可能为NA;
④BaSO3和H2O2的反应生成硫酸钡和水.
解答 解:①阴离子可能有氧化性,如MnO4-等,故错误;
②有电子转移的化学反应是氧化还原反应,该反应方程式为3NO2+2H2O=2HNO3+NO,该反应中N元素化合价由+4价变为+5价、+2价,所以有电子转移,属于氧化还原反应,故正确;
③1mol Cl2参加反应转移电子数可能为NA,如Cl2+2NaOH=NaCl+NaClO+H2O,故错误;
④BaSO3和H2O2的反应生成硫酸钡和水,反应方程式为BaSO3+H2O2=BaSO4+H2O,该反应中O元素化合价由-1价变为-2价、S元素化合价由+4价变为+6价,有电子转移,属于氧化还原反应,故正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生分析判断能力,明确氧化还原反应本质、物质性质是解本题关键,转移规律中的异常现象,易错选项是③.


科目:高中化学 来源: 题型:解答题
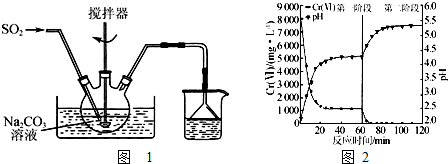
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的球棍模型为: | B. | 次氯酸的结构式为:H一C1一O | ||
| C. | 淀粉的结构简式为:[C6H12O6]n | D. | 乙烯的电子式为: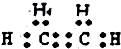 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3-→NaOH | B. | CaCO3-→Ca(OH)2 | C. | NaNO3-→NaCl | D. | CuO-→Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤⑥⑧ | B. | ④⑤⑦⑧ | C. | ③④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn 粒与稀硫酸反应制取氢气 | |
| B. | 二氧化碳与氢氧化钠溶液反应生成碳酸钠 | |
| C. | 氧化铁在高温下与一氧化碳反应 | |
| D. | 碳酸钠溶液与石灰乳混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
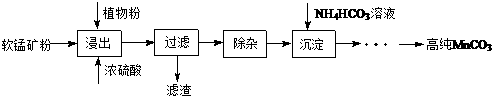
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH(CH2)2CH3 | B. | CH2=CH(CH2)3CH3 | ||
| C. | CH3CH=CHCH=CHCH3 | D. | CH3CH2CH=CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60与金刚石一样属于原子晶体 | |
| B. | 水结冰体积膨胀、密度变小,这一事实与水分子间存在氢键有关 | |
| C. | 分子晶体中必含化学键 | |
| D. | 干冰升华破坏了共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com