
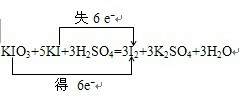
 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
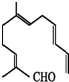 其分子式为
其分子式为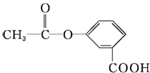 关于它的结构性质分析.
关于它的结构性质分析.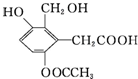 分子中含有的官能团名称是:
分子中含有的官能团名称是:查看答案和解析>>
科目:高中化学 来源: 题型:
 用石墨电极电解500mL含一种溶质的某蓝色溶液,如图所示,观察到A极表面有红色固体物质生成,B极上有无色气体生成;当溶液中的原有溶质完全电解后,取出A极,洗涤、干燥、称量,电极增重1.6g,回答下列问题:
用石墨电极电解500mL含一种溶质的某蓝色溶液,如图所示,观察到A极表面有红色固体物质生成,B极上有无色气体生成;当溶液中的原有溶质完全电解后,取出A极,洗涤、干燥、称量,电极增重1.6g,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
18 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜溶于硝酸:H++OH-=H2O |
| B、铜跟浓HNO3反应:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑ |
| C、氨水跟稀HNO3反应:H++OH-=H2O |
| D、铁跟稀HNO3反应:Fe+2H+=Fe2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com