
 现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:分析 (1)增大反应物浓度、升高温度、增大反应物接触面积都加快反应速率;
(2)降低浓度、降低温度、减小反应物接触面积等都降低反应速率;
(3)反应物浓度越大反应速率越快,温度越高反应速率越快.
解答 解:(1)增大反应物浓度、升高温度、增大反应物接触面积都加快反应速率,
A.将盐酸的用量增加一倍,盐酸浓度不变,则反应速率不变,故选;
B.盐酸的浓度增加一倍,用量减半,反应物浓度增大,反应速率加快,故不选;
C.适当加热,增大活化分子百分数,反应速率加快,故不选;
D.将块状碳酸钙换成粉末状固体,增大反应物接触面积反应速率加快,故不选;
故选A;
(2)降低浓度、降低温度、减小反应物接触面积等都降低反应速率,
A.加入蒸馏水,氢离子浓度降低,反应速率减慢,故正确;
B.加入NaCl溶液,氢离子浓度降低,反应速率减慢,故正确;
C.加入浓盐酸,氢离子浓度增大,反应速率加快,故错误;
故选AB;
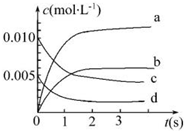
(3)反应物浓度越大反应速率越快,温度越高反应速率越快,开始时氢离子浓度大、溶液温度低,该反应是放热反应,随着反应的进行,溶液温度升高、氢离子浓度降低,但温度对反应速率影响大于离子浓度降低,所以反应速率增大,
故答案为:该反应是放热反应,随着反应的进行,溶液温度升高、氢离子浓度降低,但温度对反应速率影响大于离子浓度降低.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生知识运用及识图能力、分析判断能力,明确浓度、温度、反应物接触面积对反应速率影响原理是解本题关键,注意(3)题曲线变化原因,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有Cl- | B. | 乙溶液含有Mg2+ | C. | 丙溶液含有Ba2+ | D. | 丁溶液含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和液溴光照取代产物为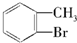 | |
| B. | 乙苯和氯气光照生成产物有11种 | |
| C. | 邻二甲苯和液溴在光照下取代产物可能为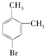 | |
| D. | 甲苯和氯气在光照条件下生成一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
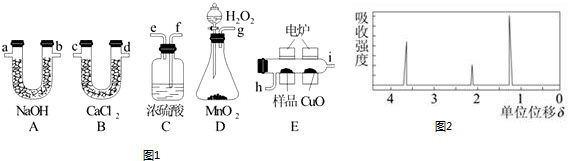
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别蘸有浓氨水和浓盐酸的两根玻璃棒靠近时有白烟生成 | |
| B. | 氨气极易溶解于水,因此可用来做喷泉实验 | |
| C. | 氯化铵受热分解有氨气生成,因此实验室可以用加热氯化铵的方法制备氨气 | |
| D. | 氨具有还原性,可以被氧化成NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
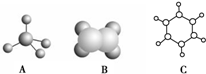 如图中A、B、C分别是三种有机物的结构模型:
如图中A、B、C分别是三种有机物的结构模型:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com