
ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
| A£®ŗ¬ÓŠ½šŹōŌŖĖŲµÄĄė×ÓŅ»¶ØŹĒŃōĄė×Ó£¬½šŹōŃōĄė×Ó±»»¹ŌŅ»¶ØµĆµ½½šŹōµ„ÖŹ |
| B£®pHĻąµČµÄNaOH”¢NaHCO3ŗĶNa2CO3ČżÖÖČÜŅŗ£ŗ c(NaOH)£¼c(NaHCO3)£¼c(Na2CO3) |
| C£®³£ĪĀĻĀ£¬c£ØNH4+£©ĻąµČµÄ4ÖÖČÜŅŗ£ŗ¢Ł£ØNH4£©2SO4¢Ś£ØNH4£©2Fe£ØSO4£©2¢ŪNH4Cl ¢Ü£ØNH4£©2CO3£¬ČÜÖŹĪļÖŹµÄĮæÅØ¶Č“óŠ”¹ŲĻµŹĒ£ŗ¢Ś<¢Ł<¢Ü<¢Ū |
| D£®Ä³ĪĀ¶ČŹ±Ė®µÄĄė×Ó»ż³£ŹżKW=10-13Čō½«“ĖĪĀ¶ČĻĀpH=11µÄNaOHČÜŅŗaLÓėpH=1µÄĻ”ĮņĖįbL»ģŗĻ£¬ČōĖłµĆ»ģŗĻŅŗpH=2£¬Ōņa£ŗb=2£ŗ9 |
C
½āĪöŹŌĢā·ÖĪö£ŗA”¢ŗ¬ÓŠ½šŹōŌŖĖŲµÄŅ²ÓŠŅõĄė×Ó£¬ČēAlO2-£¬½šŹōŃōĄė×Ó±»»¹ŌŅ»¶ØµĆµ½½šŹōµ„ÖŹ£¬ČēFe3+±»»¹ŌµĆFe2+£¬“ķĪó£»B”¢pHĻąµČµÄNaOH”¢NaHCO3ŗĶNa2CO3ČżÖÖČÜŅŗ£¬ĒāŃõøłÅضČĻąĶ¬£¬NaOHĶźČ«µēĄė£¬Ņņ“ĖĖüµÄÅضČ×īŠ”£¬øł¾ŻŌ½ČõŌ½Ė®½ā£¬Ģ¼ĖįÄʵÄĖ®½ā³Ģ¶Č“óÓŚĢ¼ĖįĒāÄĘ£¬Ņņ“ĖĢ¼ĖįĒāÄʵÄÅضČ×ī“󣬓ķĪó£»C”¢³£ĪĀĻĀ£¬c£ØNH4+£©ĻąµČµÄ4ÖÖČÜŅŗ£¬¢Ł£ØNH4£©2SO4 ¢Ś£ØNH4£©2Fe£ØSO4£©2¢Ü£ØNH4£©2CO3ÖŠŗ¬ÓŠµÄNH4+¶ą£¬Ņņ“ĖĖüĆĒµÄÅضČ×īŠ”£¬ŅņĪŖ¢Ś£ØNH4£©2Fe£ØSO4£©2ÖŠŃĒĢśĄė×ÓĖ®½āĻŌĖįŠŌ£¬ŅÖÖĘNH4+Ė®½ā£¬Ņņ“ĖĖü×īŠ”£¬¢Ü£ØNH4£©2CO3ÖŠĢ¼ĖįøłĄė×ÓĖ®½āĻŌ¼īŠŌ£¬“Ł½ųNH4+Ė®½ā£¬Ė®½ā³Ģ¶Č“ó£¬Ņņ“ĖĖüŌŚÕāČżøöÖŠ×ī“󣬢ŪNH4ClÖŠŗ¬ÓŠµÄNH4+ÉŁ£¬Ņņ“ĖĖüµÄÅضČ×ī“ó£¬ÕżČ·£»D”¢Ä³ĪĀ¶ČŹ±Ė®µÄĄė×Ó»ż³£ŹżKW=10-13£¬pH=11µÄNaOHČÜŅŗ£¬ĒāŃõøłµÄÅضČĪŖ0.01mol/L£¬pH=1µÄĻ”ĮņĖį£¬ĒāĄė×ÓµÄÅضČĪŖ0.1mol/L£¬»ģŗĻĖłµĆpH=2£¬ĒāĄė×ÓµÄÅضČĪŖ0.1mol/L£¬ĖµĆ÷Ėį¹żĮ棬(0.1b-0.01a)/(a+b)=0.01£¬Ōņa£ŗb=9£ŗ11£¬“ķĪó”£
æ¼µć£ŗæ¼²éĖ®½āĘ½ŗā”¢pHµÄ¼ĘĖć



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠĪļÖŹÓėĖ®·“Ó¦²»ŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ
| A£®NO2 | B£®CaO | C£®Cl2 | D£®Na2O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŌŚ100 mLµČĪļÖŹµÄĮæµÄHBrŗĶH2SO3µÄ»ģŗĻŅŗĄļĶØČė0£®01 mol Cl2£¬ÓŠŅ»°ėBr£±äĪŖBr2(ŅŃÖŖBr2ÄÜŃõ»ÆH2SO3)”£ŌČÜŅŗÖŠHBrŗĶH2SO3µÄÅØ¶Č¶¼µČÓŚ
| A£®0£®0075 mol”¤L£1 | B£®0£®008 mol”¤L£1 |
| C£®0£®075 mol”¤L£1 | D£®0£®08 mol”¤L£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
4.6gĶĆ¾ŗĻ½šĶźČ«ČܽāÓŚ100mlĆܶČĪŖ1.40g/ml”¢ÖŹĮæ·ÖŹżĪŖ63%µÄÅØĻõĖįÖŠ£¬µĆµ½4480mlNO2ŗĶ336 ml N2O4µÄ»ģŗĻĘųĢå(±ź×¼×“æö)£¬Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠ¼ÓČė1.0mol/LNaOHČÜŅŗÖĮĄė×ÓĒ”ŗĆČ«²æ³ĮµķŹ±£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ £Ø £©
| A£®øĆŗĻ½šÖŠĶÓėĆ¾µÄĪļÖŹµÄĮæÖ®±ČŹĒ46:69 |
| B£®øĆÅØĻõĖįÖŠHNO3µÄĪļÖŹµÄĮæÅØ¶ČŹĒ14.0mol/L |
| C£®²śÉś³Įµķ8.51 g |
| D£®Ąė×ÓĒ”ŗĆĶźČ«³ĮµķŹ±£¬¼ÓČėNaOHČÜŅŗµÄĢå»żŹĒ230mL |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻņŅ»½ą¾»øÉŌļµÄÉÕ±ÖŠ¼ÓČė44.4gAl·ŪÓėFe·Ū»ģŗĻĪļ£¬Č»ŗó¼ÓČė¹żĮæµÄŃĪĖį£¬²śÉś±źæöĻĀĘųĢå26.88L”£Čō½«øĆ»ģŗĻĪļ¼ÓČė500mL14 mol”¤L-1µÄHNO3ÖŠ£Ø²»æ¼ĀĒ·¢Éś¶Ū»Æ£©£¬²śÉśµÄĘųĢå£Ø±ź×¼×“æöĻĀ²ā¶Ø£©ČēĶ¼ĖłŹ¾£¬¼ŁÉčHNO3µÄ»¹Ō²śĪļĪŖNOÓėNO2£¬ÄĒĆ“ĄķĀŪÉĻ“ÓÄÄŅ»Ź±æĢæŖŹ¼²śÉśNOĘųĢå?£Ø¼ŁÉčÅØ¶ČŠ”ÓŚ9mol/LĪŖĻ”HNO3£©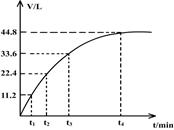
| A£®t1 | B£®t2 | C£®t3 | D£®t4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
æĘ¼¼¹¤×÷ÕßĢį³öÓĆĀĮ·Ū“¦Ąķŗ¬ŃĒĻõĖįŃĪ·ĻĖ®µÄĖ¼Ā·£ŗµ÷½ŚŃĒĻõĖįŃĪ·ĻĖ®Ėį¼īŠŌ£¬Ź¹ĘäpH£¾12£¬Č»ŗó¼ÓČėŹŹĮæµÄĀĮ·Ū”¢½Į°č£¬“Ó¶ųŹµĻÖŌ¤ĘŚĒŅµÄ”£ĻĀĮŠÅŠ¶Ļ“ķĪóµÄŹĒ
| A£®·ĻĖ®“¦ĄķŹ±ĀĮµ„ÖŹ×Ŗ»ÆĪŖAl3+ | B£®·ĻĖ®“¦ĄķÖŠ£¬ŃĒĻõĖįŃĪ±»»¹Ō |
| C£®“¦Ąķ¹ż³ĢÖŠ£¬OHŅ»²ĪÓėĮĖ·“Ó¦ | D£®ĀĮ·ŪæÅĮ£“óŠ”Ó°Ļģ·ĻĖ®“¦ĄķµÄĖŁĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠ±ä»ÆÖŠ£¬±ŲŠė¼ÓČė»¹Ō¼Į²ÅÄÜ·¢ÉśµÄŹĒ
| A£®FeCl2”śFeCl3 | B£®H2O”śH2 | C£®Al”śNaAlO2 | D£®CO2”śC |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ÓŠČēĻĀ·“Ó¦£ŗ¢ŁH2S£«H2O2=S”ż£«2H2O
¢ŚS£«O2£½SO2””¢ŪSO2£«Br2£«H2O=HBr£«H2SO4
ĻĀĮŠĪļÖŹµÄŃõ»ÆŠŌĒæČõÅŠ¶ĻÕżČ·µÄŹĒ(””””)
| A£®H2O2>S””O2>SO2 | B£®H2O2>O2””Br2>O2 |
| C£®Br2>H2O2””SO2>S | D£®Br2>H2O2””Br2>SO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĪŖŌ¤·Ą”°H1N1”±¼×ŠĶĮ÷øŠ,Ķ¬Ń§ĆĒĆæĢģÓĆ”°84”±Ļū¶¾Ņŗ(NaClOČÜŅŗ)Ļū¶¾,ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
| A£®NaClOČÜŅŗµÄĻū¶¾ŌĄķŹĒŹ¹µ°°×ÖŹ±äŠŌ |
| B£®1 mol Cl2Óė×ćĮæNaOHČÜŅŗ·“Ó¦×ŖŅĘ2 molµē×Ó |
| C£®NaClOČÜŅŗµÄĘÆ°×ŌĄķÓėNa2O2ĻąĶ¬,ÓėSO2²»Ķ¬ |
| D£®”°84”±Ļū¶¾ŅŗÓė”°½ą²ŽĮé”±(ŃĪĖį)»ģŗĻŹ¹ÓĆæÉÄÜ»į²śÉśÓŠ¶¾µÄĀČĘų |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com