
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示: 
(1)装置C的作用是 .
(2)若要从FeSO4溶液获得FeSO47H2O晶体,必须进行的实验操作步骤:、、过滤、洗涤、自然干燥.
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应. ①写出SO2与FeCl3溶液反应的离子方程式;
②请写出检验A烧杯中有Fe2+生成的操作方法;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣ . 该做法(填“合理”或“不合理”),理由是 .
(4)能表明I﹣的还原性弱于SO2的现象是 .
【答案】
(1)除去多余的SO2 , 防止污染大气
(2)蒸发浓缩;冷却结晶
(3)2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;不合理;硝酸具有氧化性,亚硫酸根可以被硝酸氧化成硫酸根离子
(4)B中蓝色褪去
【解析】解:(1)二氧化硫气体是酸性氧化物,具有刺激性气味,直接排放会污染大气,由于二氧化硫能和碱反应生成盐和水,可用碱液处理二氧化硫,所以装置C的作用为:吸收SO2尾气,防止污染空气,故答案为:除去多余的SO2 , 防止污染大气;(2)蒸发浓缩、冷却结晶是从溶液中获得晶体常采用的方法,产生沉淀后通过过滤实现分离,故答案为:蒸发浓缩;冷却结晶;(3)①因为二氧化硫具有还原性,三价铁具有氧化性,则二氧化硫与铁离子反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+ , 故答案为:2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+;②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液,具体操作为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;故答案为:取A烧杯中少量溶液,滴加高锰酸钾溶液,如果退色则说明含有二价铁离子,反之没有;③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根,所以不可证明反应生成了SO42﹣ , 该方法不合理,故答案为:不合理;硝酸具有氧化性,亚硫酸根可以被硝酸氧化成硫酸根离子;(4)B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4 , 依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故答案为:B中蓝色褪去. (1)二氧化硫具有刺激性气味,污染空气,用氢氧化钠溶液吸收二氧化硫,防止空气污染;(2)从FeSO4溶液获得FeSO47H2O晶体,进行蒸发浓缩,冷却结晶,过滤,洗涤、自然干燥就得到FeSO47H2O,回收硫酸亚铁;(3)①根据装置A二氧化硫具有还原性,三价铁具有氧化性结合氧化还原反应书写离子方程式;②一般检验有Fe2+生成先用KSCN溶液无现象,再用氯水氧化亚铁离子生产三价铁溶液变红来检验,但是现在溶液中还可能含有三价铁,所以不能用KSCN溶液和氯水来检验,选用高锰酸钾溶液利用高锰酸钾的强氧化性判断;③亚硫酸根能与硝酸发生氧化还原反应生产硫酸根;(4)B中蓝色褪去,说明二氧化硫和碘单质反应,依据氧化还原反应中还原剂的还原性大于还原产物分析.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】其溶液中可能含有SO42-、CO32-,为检验是否含有SO42-,除需用BaCl2溶液外,还需用到的溶液是
A.稀硫酸B.稀盐酸C.NaOH溶液D.NaNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对乙酰氨基苯酚(F)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧、关节痛、神经痛、偏头痛等,它可用最简单的烯烃A等合成:
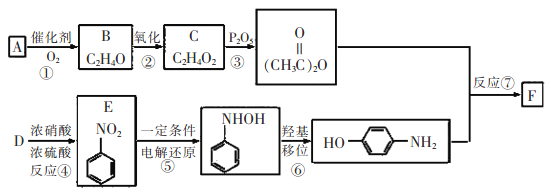
已知:![]()
请回答下列问题:
(1)E的名称为__________,C中含有的官能团是__________。
(2)B的结构简式是__________,反应③的反应类型是__________。
(3)F与足量NaOH溶液反应的化学方程式为__________。
(4)F的同分异构体有很多,其中一类同时满足下列条件的同分异构体共有_______种。
①苯环上有三个侧链;②与FeCl3溶液发生显色反应;③能发生银镜反应且醛基直接连在苯环上。
(5)参照F的合成路线,设计一条以溴苯为起始原料制备![]() 的合成路线___________。
的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体Y 33.6 L(在标准状况下)。将反应后的溶液稀释到1 L,测得溶液的c(H+)=0.1 mol·L-1,则下列叙述不正确的是( )
A. 气体Y中SO2和H2的体积比为4∶1 B. 气体Y是SO2和H2的混合物
C. 反应中共消耗锌97.5 g D. 反应中共转移电子3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,符合如图所示能量变化的是( ) 
A.H2在Cl2中燃烧
B.Ba(OH)28H2O和NH4Cl固体的反应
C.Na和H2O的反应
D.生石灰溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如图所示: 
(1)装置A中还应安装的玻璃仪器是 , 装置B用冰水浴的原因是 .
(2)装置A中产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: .
(3)①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2 , 写出装置C中生成这两种钠盐的离子方程式: . ②饱和溶液在温度低于38℃时析出晶体NaClO2 . 3H2O,在温度高于38℃时析出晶体NaClO2 . 请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a.;b.;c.洗涤;d.干燥.
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2 . 用H2O2作还原剂制备ClO2更受欢迎,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com