
| A. | 一定含有Mg+、Al3+、Cl-,不含K+、NH4+ | |
| B. | 一定含有K+、Mg2+、Cl-,不含NH4+,可能含有Al3+ | |
| C. | c(Mg2+)=1.00mol•L-1,c(Cl-)=4.00mol•L-1 | |
| D. | c(K+)=0.50mol•L-1,c(Al3+)=1.00mol•L-1 |
分析 ①加入KOH溶液加热,有白色沉淀产生,无刺激气味气体生成,说明原溶液中可能含有 Mg2+、Al3+;一定没有NH4+;滤液中c(OH-)=0.2mol•L-1,证明碱过量,则溶液中一定含有Mg2+;
②加入足量的AgNO3溶液,生成白色沉淀11.48g,溶液中一定含有Cl-;
氢氧化镁沉淀的质量为0.58g,物质的量为$\frac{0.58g}{58g/mol}$=0.01mol,则溶液中含有0.01mol镁离子,消耗的n(OH-)=0.02mol,加入25.0mL 2.00 mol•L-K0H溶液,则加入的氢氧化钾的物质的量为0.025L×2.00mol/L=0.05mol,滤液中剩余的氢氧化钾物质的量为0.05L×0.20mol/L=0.01mol,故Al3+消耗了0.02mol氢氧化钠生成偏铝酸钠,所以溶液中一定含有铝离子物质的量为0.005mol;
另取10.0mL该溶液,加人足量的AgNO3溶液,生成白色沉淀5.74g,沉淀为氯化银,物质的量为$\frac{5.74g}{143.5g/mol}$=0.04mol,说明溶液中含有氯离子物质的量为0.04mol;
溶液中含有镁离子0.01mol,铝离子0.005mol,氯离子0.04mol,则电荷数关系:0.01mol×2+0.005mol×3<0.04mol×1,所以溶液中一定含有钾离子,其物质的量为0.004mol×1-0.01mol×2+0.005mol×3=0.005mol,进而确定离子的浓度大小.
解答 解:①加入KOH溶液加热,有白色沉淀产生,无刺激气味气体生成,说明原溶液中可能含有 Mg2+、Al3+;一定没有NH4+;滤液中c(OH-)=0.2mol•L-1,证明碱过量,则溶液中一定含有Mg2+;
②加入足量的AgNO3溶液,生成白色沉淀11.48g,溶液中一定含有Cl-;
氢氧化镁沉淀的质量为0.58g,物质的量为$\frac{0.58g}{58g/mol}$=0.01mol,则溶液中含有0.01mol镁离子,消耗的n(OH-)=0.02mol,加入25.0mL 2.00 mol•L-K0H溶液,则加入的氢氧化钾的物质的量为0.025L×2.00mol/L=0.05mol,滤液中剩余的氢氧化钾物质的量为0.05L×0.20mol/L=0.01mol,故Al3+消耗了0.02mol氢氧化钠生成偏铝酸钠,所以溶液中一定含有铝离子物质的量为0.005mol;
另取10.0mL该溶液,加人足量的AgNO3溶液,生成白色沉淀5.74g,沉淀为氯化银,物质的量为$\frac{5.74g}{143.5g/mol}$=0.04mol,说明溶液中含有氯离子物质的量为0.04mol;
溶液中含有镁离子0.01mol,铝离子0.005mol,氯离子0.04mol,则电荷数关系:0.01mol×2+0.005mol×3<0.04mol×1,所以溶液中一定含有钾离子,其物质的量为0.004mol×1-0.01mol×2+0.005mol×3=0.005mol,
A.溶液中一定含有离子为K+、Mg2+、Al3+、Cl-,一定不含NH4+,故A错误;
B.溶液中一定含有铝离子,故B错误;
C.c(Mg2+)=$\frac{0.01mol}{0.01L}$=1.00mol/L,c(Cl-)=$\frac{0.04mol}{0.01L}$=4.00mol•L-1,故C正确;
D.c(K+)=$\frac{0.005mol}{0.01L}$=0.5mol/L,c(Al3+)=$\frac{0.005mol}{0.01L}$=0.5mol/L,故D错误;
故选:C.
点评 离子反应的计算及推断,为高频考点,把握沉淀的成分、离子检验及电荷守恒应用等为解答的关键,侧重考查学生分析、推断能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.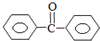 $→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$
$→_{浓H_{2}SO_{4}、CH_{3}COOH}^{K_{2}S_{2}O_{8}}$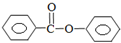
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分馏装置 | B. |  配制150 mL 0.10 mol•L-1盐酸 | ||
| C. |  烧瓶内溶液变蓝色 | D. |  出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CHO与新制氢氧化铜悬浊液加热反应,最后酸化 | |
| B. |  与足量氢气在催化剂、加热条件下反应 与足量氢气在催化剂、加热条件下反应 | |
| C. |  与足量氢气在催化剂、加热条件下反应 与足量氢气在催化剂、加热条件下反应 | |
| D. |  与氧气在催化剂、加热条件下反应 与氧气在催化剂、加热条件下反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com