
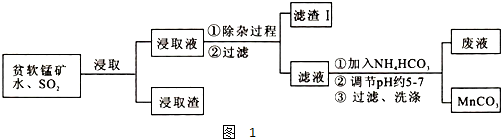
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化铝 | 3.3 | 5.2 |
| 氢氧化亚铁 | 7.6 | 9.6 |
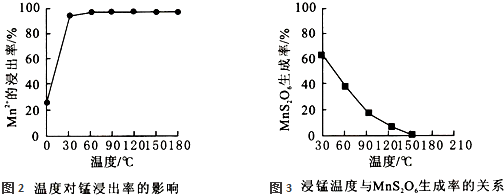
 MnS2O6,温度选择不合理时会产生杂质MnS2O6造成锰损失,根据图象知,温度越高,MnS2O6的生成率越低,所以该反应的正反应是放热反应,焓变小于△H<0;当温度为 150℃时,MnS2O6的生成率为0,故选温度为150℃,故答案为:b;
MnS2O6,温度选择不合理时会产生杂质MnS2O6造成锰损失,根据图象知,温度越高,MnS2O6的生成率越低,所以该反应的正反应是放热反应,焓变小于△H<0;当温度为 150℃时,MnS2O6的生成率为0,故选温度为150℃,故答案为:b;| 115 |
| 55 |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
 酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:
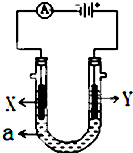 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定条件下,水由气态变成液态 |
| B、Ag+(aq)+Cl-(aq)=AgCl(s) |
| C、4NO2(g)+O2(g)═2N2O5 (g) |
| D、火柴盒中的火柴散落到地上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C4H9Br |
| B、C5H11Br |
| C、C6H13Br |
| D、C7H15Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
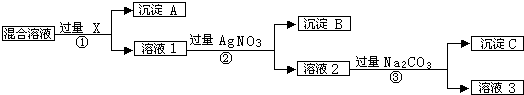
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃可燃性气体前验纯 |
| B、气体实验装置在实验前进行气密性检查 |
| C、胶头滴管不能交叉使用 |
| D、实验剩余的药品不能放回原试剂瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com