
| A. | 该温度下,0.0l mol/L醋酸溶液的pH=4 | |
| B. | 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10 | |
| C. | 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7 | |
| D. | 该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH>4.7 |
分析 A、醋酸是弱酸,存在电离平衡,加水稀释时电离平衡正向移动;
B、相同物质的量的醋酸中和NaOH的物质的量相同;
C、醋酸和醋酸钠浓度均为0.1 mol/L的混合溶液pH=4.7,则醋酸和醋酸钠溶液浓度分别为0.1 mol/L和0.2mol/L的混合溶液酸性减弱;
D、0.2 mol•L-1盐酸溶液和0.4 mol•L-1醋酸钠溶液等体积混合后得到物质的量浓度均为0.1mol/L的醋酸和醋酸钠的混合溶液.
解答 解:0.2 mol•L-1醋酸溶液和0.2 mol/L醋酸钠溶液等体积混合后,得到醋酸和醋酸钠浓度均为0.1 mol/L,混合液的pH=4.7.
A、醋酸是弱酸,存在电离平衡,加水稀释时电离平衡正向移动,氢离子物质的量增多,0.01 mol•L-1醋酸溶液的3<pH<4,故A错误;
B、1体积0.1 mol•L-1醋酸和10体积0.01 mol/L醋酸溶液中所含醋酸物质的量相同,所以中和等体积0.1 mol•L-1的NaOH溶液,消耗两醋酸的体积比为1:10,故B正确;
C、0.2 mol•L-1醋酸溶液和0.4 mol•L-1醋酸钠溶液等体积混合后,得到0.1 mol/L醋酸和0.2mol/L醋酸钠的混合溶液,其酸性弱于醋酸和醋酸钠浓度均为0.1 mol/L的混合溶液,其pH>4.7,故C错误;
D、0.2 mol•L-1盐酸溶液和0.4 mol•L-1醋酸钠溶液等体积混合后,得到醋酸和醋酸钠浓度均为0.1 mol/L的混合溶液,其pH=4.7,故D错误;
故选B.
点评 本题考查了弱电解质存在电离平衡、醋酸与其对应的钠盐混合溶液的pH判断,注意把握弱酸的电离特点和影响弱酸电离平衡的因素,题目难度中等,侧重于考查学生的分析能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+) | |
| B. | Ka1(H2CO3)•Ka2(H2CO3)<KW | |
| C. | c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤④①② | B. | ③④②①⑤ | C. | ④①②⑤③ | D. | ③②④①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
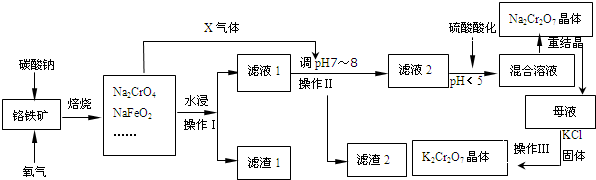
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-?CH3COO-+H2O | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | S2-+H2O?HS-+OH- | D. | NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气前要检验纯度,以免发生爆炸 | |
| B. | 不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 | |
| C. | CO气体有毒,处理CO尾气的方法一般是将其点燃,转化成无毒的CO2 | |
| D. | 在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
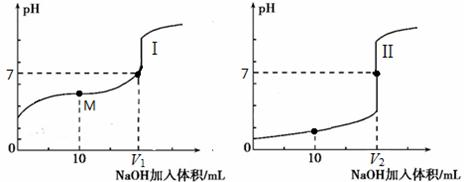
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com