
| A. | 分散系的分类: | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 如图显示的是树林的晨曦,该现象与丁达尔效应有关 | |
| D. | 在Fe(OH)3胶体中加入过量硫酸后会出现红褐色沉淀 |
分析 A、分散系根据分散质粒子直径大小分为溶液、浊液和胶体;
B、胶体有丁达尔效应,溶液没有;
C、大气是胶体;
D、胶体遇电解质溶液发生聚沉,而氢氧化铁沉淀能溶于过量的硫酸.
解答 解:A、分散系根据分散质粒子直径大小分为溶液、浊液和胶体,溶液的分散质粒子小于10-9nm,胶体的胶粒介于10-9m到10-7m之间,浊液的分散质粒子直径大于10-7m,故A正确;
B、胶体有丁达尔效应,溶液没有,故可以用光照的方法来鉴别溶液和胶体,故B正确;
C、大气是胶体,当有阳光照射清晨的空气时,会有晨曦的现象,故C正确;
D、氢氧化铁胶体遇电解质溶液发生聚沉变为氢氧化铁沉淀,而氢氧化铁沉淀能溶于过量的硫酸,故D错误.
故选D.
点评 本题考查了分散系的分类标准和胶体的性质,难度不大,应注意的是分散系的本质区别是分散质粒子直径大小.


科目:高中化学 来源: 题型:选择题
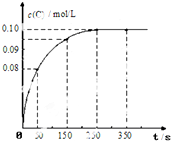 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在0~50s的平均速率v(C)=1.6×10-3mol/(L•s) | |
| B. | 该温度下,反应的平衡常数K=0.025 | |
| C. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 | |
| D. | 反应达平衡后,再向容器中充入 1 mol A,该温度下再达到平衡时0.1mol/L<c(C)<0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
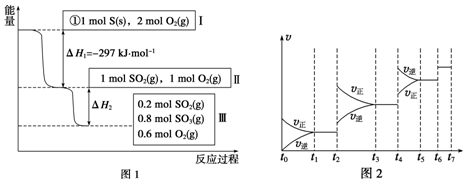
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③②①⑤ | B. | ④⑤③②① | C. | ④③①②⑤ | D. | ④②③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通过Na2O2粉末后固体物质质量增加 | |
| B. | 在NaClO溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| C. | Na2S溶液在空气中长期放置变浑浊的离子方程式为2S2-+O2+4H+=2S↓+2H2O | |
| D. | NH4HCO3溶液中滴加足量NaOH溶液的离子方程式为HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 32g氧气中含有2mol氧 | |
| C. | 58.5gNaCl中含有l mol NaCl分子 | |
| D. | 0.l mol二氧化碳含有6.02×1022个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属银的表面生成一层黑色物质 | |
| B. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| C. | 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 | |
| D. | 为保护海轮的船壳,常在船壳上镶入锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com