

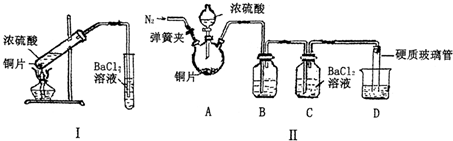
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
| 实验前向A中通入N2 | 排除装置中的空气 |
| 在A、C之间加一个盛有饱和亚硫酸氢钠溶液的洗气瓶 | 除去挥发出来的H2SO4蒸汽 |
| 导管末端连接硬质玻璃管,插入盛氢氧化钠溶液的烧杯中 | 吸收尾气,同时防止倒吸 |
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
| 实验前向A中通入N2 | 排除装置中的空气 |
| 在A、C之间加一个盛有饱和亚硫酸氢钠溶液的洗气瓶 | 除去挥发出来的H2SO4蒸汽 |
| 导管末端连接硬质玻璃管,插入盛氢氧化钠溶液的烧杯中 | 吸收尾气,同时防止倒吸 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 硫酸钾中阴离子所带电荷数为NA |
| B、乙烯和环丙烷(C3H6)组成的28g混合气体中含有NA个氢原子 |
| C、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、AlCl3 溶液中投入过量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑ |
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| D、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | ||||||||||
| B、向Cr2O72-+H2O?2CrO42-+2H+的平衡体系中滴加10~20滴6mol/LNaOH溶液颜色由橙色变黄色 | ||||||||||
C、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)
| ||||||||||
D、已知:
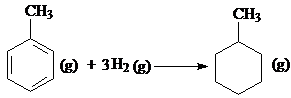 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸乙酯(HCOOC2H5) |
| B、乙酸乙酯(CH3COOC2H5) |
| C、葡萄糖(C6H12O6) |
| D、淀粉〔(C6H10O5)n〕 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com