
����Ŀ��ijͬѧ�������ݻ���ͬ���ܱ������У��ֱ��о����ֲ�ͬ�����»�ѧ��Ӧ2X(g)![]() Y(g)��W(g)�Ľ������������ʵ��������������T1��ʵ����������T2�����ǵ���ʼŨ�Ⱦ���c(X)��1.0 mol��L��1��c(Y)��c(W)��0����÷�Ӧ��X��Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ����(����)
Y(g)��W(g)�Ľ������������ʵ��������������T1��ʵ����������T2�����ǵ���ʼŨ�Ⱦ���c(X)��1.0 mol��L��1��c(Y)��c(W)��0����÷�Ӧ��X��Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ����(����)

A.��ʵ������ȣ�ʵ��������ʹ���˴���
B.��ʵ������ȣ�ʵ������ֻ�ı��¶ȣ����¶�T1<T2���÷�Ӧ�����ȷ�Ӧ
C.��ʵ�������������У��ﵽƽ��״̬ʱX������ٷֺ�����ͬ
D.����ʼŨ��c(X)��0.8 mol��L��1��c(Y)��c(W)��0������������ʵ������ͬ����ƽ��Ũ��c(X)��0.4 mol��L��1
���𰸡�C
��������
A����ͼ��֪��ʵ��������ƽ���ʱ��̣�ƽ��ʱʵ������ʵ������X��Ũ�Ȳ��䣬˵����Ӱ��ƽ���ƶ����÷�Ӧǰ����������ʵ������䣬�ʿ���Ϊ����ѹǿ��ʹ�ô�����ѡ��A��ȷ��
B���¶�Խ�߷�Ӧ����Խ�죬����ƽ���ʱ��Խ�̣����¶�T1��T2���¶�Խ�ߣ�ƽ��ʱX��Ũ��ԽС��˵�������¶�ƽ��������Ӧ�����ƶ���������Ӧ�����ȷ�Ӧ��ѡ��B��ȷ��
C����ͼ��֪��ʵ��I��II��ʱX��Ũ����ȣ�ʵ����ƽ��ʱX��Ũ��С��X�����ʵ���С���÷�Ӧǰ����������ʵ������䣬ʵ����ƽ��ʱX������ٷֺ�����ʵ��I��II�ͣ�ѡ��C����
D����ͼ��֪��ʵ��������ƽ��ʱX��Ũ��Ϊ0��5mol/L����X��Ũ�ȱ仯��Ϊ1mol/L-0��5mol/L��0��5mol/L��Xת����Ϊ![]() ��50%����ʼŨ��c��X����0��8mol/L��Ũ�Ƚ��ͣ�ѹǿ��С���÷�Ӧǰ����������ʵ������䣬ƽ�ⲻ�ƶ���X��ת���ʲ��䣬��ƽ��Ũ��c��X����0��8mol/L��50%��0��4mol/L��ѡ��D��ȷ��
��50%����ʼŨ��c��X����0��8mol/L��Ũ�Ƚ��ͣ�ѹǿ��С���÷�Ӧǰ����������ʵ������䣬ƽ�ⲻ�ƶ���X��ת���ʲ��䣬��ƽ��Ũ��c��X����0��8mol/L��50%��0��4mol/L��ѡ��D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. C2H5OH(l)��3O2(g)��2CO2(g)��3H2O(g) ��H=��1234.8kJ��mol��1
���ۣ�C2H5OH��ȼ���� ��H=��1234.8 kJ��mol��1
B. ϡ��Һ����H��(aq)��OH��(aq)��H2O(l) ��H����57.3 kJ��mol��1
���ۣ���ϡ������NaOH��ϡ��Һ��Ϻ�����1 mol H2O���ɣ���ų�����������57.3kJ
C. C(s,ʯī)��C(s,���ʯ) ��H=��1.5kJ��mol��1
���ۣ���ͬ�����½��ʯ��ʯī�ȶ�
D. Sn(s,��)![]() Sn(s,��) ��H=��2.1kJ��mol��1(����Ϊ��ĩ״)
Sn(s,��) ��H=��2.1kJ��mol��1(����Ϊ��ĩ״)
���ۣ�����Ʒ�ں���Ķ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ��̽��þ��Ũ����ķ�Ӧ����ͬѧ��Ϊ�����������Ƕ�������������ͬѧ��Ϊ�������������������ܲ���������Ϊ��֤�ס�����ͬѧ���ж��Ƿ���ȷ����ͬѧ��Ƶ�ʵ��װ����ͼ��ʾ��þ����Ũ���Ṳ��ʱ����������ΪX���Ҹ����巢��װ������ȥ����
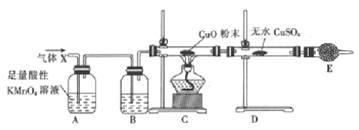
��1������E��������_____________��
��2��þ����Ũ���Ṳ��ʱ���ɶ�������Ļ�ѧ����ʽΪ_____________��
��3����ͬѧ��Ϊ�����ܲ���������������_____________��
��4��B �м�����Լ���_______����������_____________��
��5��װ��A�з�����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ݣ�
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 |
�Ҵ� | ��144 | 78.0 | 0.789 |
���� | 16.6 | 118 | 1.05 |
�������� | ��83.6 | 77.5 | 0.900 |
Ũ����(98%) | �� | 338 | 1.84 |
��ͼΪʵ������ȡ����������װ��ͼ��
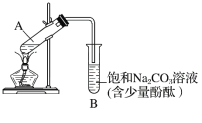
��1��������̼������Һ�Ϸ��ռ����϶�Һ��ʱ��ֹͣ���ȣ�ȡ��С�Թ�B����������á���ǰ���ʵ������Ϊ________(����ĸ)��
A���ϲ�Һ��䱡 B���²�Һ���ɫ��dz���Ϊ��ɫ C����������� D���й���ζ
��2��Ϊ���������������Ҵ�������Ļ����ɰ����в�����з��룺
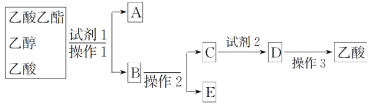
���Լ�1���ѡ��_________________________________________________��
�ڲ���1��________�����õ���Ҫ����������__________________________��
���Լ�2���ѡ��_____________________________________��
�ܲ���2��_______________________________________��
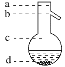
�ݲ���3���¶ȼ�ˮ�����λ��ӦΪ��ͼ��________(�a����b����c����d��)��ʾ���ڸò����У���������ƿ���¶ȼ��� ����ƿ ������Ҫ�IJ���������__________��________��________���ռ�����������¶���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ǹ��÷�չ����Ҫ�������ҹ�Ŀǰʹ�õ���Դ��Ҫ�ǻ�ʯȼ�ϡ�
��1����25 �桢101 kPaʱ��16 g CH4��ȫȼ������Һ̬ˮʱ�ų���������890.31 kJ�����ʾCH4ȼ���ȵ��Ȼ�ѧ����ʽ��_______________________��
��2����֪��C(s) + O2(g)![]() CO2(g) ��H1 ����437.3 kJmol-1
CO2(g) ��H1 ����437.3 kJmol-1
2H2(g) + O2(g) ![]() 2H2O(g) ��H2 ����571.6 kJmol-1
2H2O(g) ��H2 ����571.6 kJmol-1
2CO(g) +O2(g)![]() 2CO2(g) ��H3 ����566.0 kJmol-1
2CO2(g) ��H3 ����566.0 kJmol-1
��ú������Ҫ��Ӧ���Ȼ�ѧ����ʽ�ǣ�C(s)+ H2O(g)![]() CO(g) + H2(g) ��H ��________kJmol-1������÷�Ӧ��S ����133.7 J��mol-1��K-1 ���÷�Ӧ�ڳ����� _______�Է�����(�� ����������������)��
CO(g) + H2(g) ��H ��________kJmol-1������÷�Ӧ��S ����133.7 J��mol-1��K-1 ���÷�Ӧ�ڳ����� _______�Է�����(�� ����������������)��
��3�� ��֪��1molH��H����1molN��H����1molN��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����ӦN2(g)+3H2(g) ![]() 2NH3 (g) ��H ��_________
2NH3 (g) ��H ��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4����ױ���2����ױ��Լ�HBr������Ҫ���л��м��塣�Լױ���Һ�塢���ۡ�ˮΪԭ�������������ʵ�ʵ�鲽�����£�
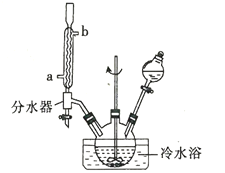
����1����������ƿ��(װ����ͼ��ʾ)����0.3g���ۣ�46g�ױ���60 mLˮ���ڷ�Һ©���м���80 gҺ�壬�ټ���10 mLˮ��
����2����Һ©���μ�Һ�壬���Ͻ��豣�ַ�Ӧ�¶���20��25��֮�䡣���Һ©���е�ˮҲȫ������������ƿ�У���������0.5h�����ɷ�Ӧ��ȫ��
����3��������ˮԡװ�ã�����������ƿ����Ӧ�¶���122��126�棬���Һ�����ˮ���У���ˮ�����Ž��²�Һ���Լ���������ƿ�У��ϲ�Һ�嵹���ձ��С�
����4����������ƿ��Һ����д����������4����ױ���2����ױ������ߵ��ܲ���Ϊ51.3g��
�ش��������⣺
(1)ʵ����Һ��ĵμӷ�ʽ��__________���ڷ�Һ©���м���80gҺ�壬�ټ���10mLˮ��Ŀ����_________��
(2)����ˮӦ�������ܵ�________(a��b)�˽��룻ʵ���з��ַ�ˮ���е�Һ����ֻ�����Ӧ��ȡ������_____________________��
(3)д����Ӧװ��������4����ױ��Ļ�ѧ����ʽ��_________�������4����ױ���2����ױ���Ӧ���õIJ�����___________��
(4)��ʵ��װ���л�ȱ�ٵı�Ҫʵ��������____________��
(5)��Ӧ�¶ȱ�����20��25��֮�䣬��ԭ����__________��
(6)��ʵ���У�һ��ױ�(4����ױ���2����ױ�)�IJ���Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��������·�����ӦA��g��+3B��g��2 C��g������H��0�����ı�������Ӧ������������������ϵ�и�����Ũ����ʱ��仯����������ͼ��ʾ������˵������ȷ����

A.��������C��ʾ��ƽ��ǰ�ķ�Ӧ������ ��C����0.1 mol/��L��s��
B.��������B��ƽ��ת����������B��Ϊ0.019
C.�����ε�ƽ�ⳣ��K���������ƽ�ⳣ��K���Ĵ�С��ϵ�ǣ�K����K��
D.�ɵ�һ��ƽ��ڶ���ƽ�⣬���ܲ�ȡ�Ĵ�ʩ�Ǵӷ�Ӧ��ϵ���Ƴ�����C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ�������,һ�������½��з�Ӧ:NO(g)+CO(g)=1/2N2(g)+CO2(g)����H=-373.2 kJ/mol����ͼ����a��ʾ�÷�Ӧ������,NO��ת�����뷴Ӧʱ��Ĺ�ϵ,���ı���ʼ����,ʹ��Ӧ���̰�������b����,�ɲ�ȡ�Ĵ�ʩ��(����)
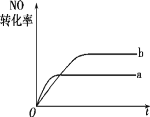
A. �Ӵ��� B. ���ܱ������м������
C. �����¶� D. ����Ӧ����NO��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����õ�ⱥ��ʳ��ˮ����ȡ�ռ���õ�ʳ��ˮ�����ξ��ơ���һ�ξ�����Ҫ���ó�������ȥ����ˮ��Ca2+��Mg2+��Fe3+��SO42-�����ӣ��������£�
��.�����ˮ�м������BaCl2��Һ�����ˣ�
��.��������Һ�м������Na2CO3��Һ�����ˣ�
��.�����������Һ��pH�����һ�ξ�����ˮ��
(1)���̢��г�ȥ��������______��
(2)���ǹ��̢������ɵIJ��ֳ���������20��ʱ���ܽ��(g/100 gH2O)��
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6��10-2 | 2.5��10-4 | 7.8��10-4 | 2.4��10-4 | 1.7��10-3 | 4.8��10-9 |
���ñ�����Ϣ�ش��������⣺
�ٹ��̢������ɵ���Ҫ������CaCO3��Mg2(OH)2CO3���______��
�ڹ��̢�ѡ�õ���BaCl2����ѡ��CaCl2��ԭ����______��
�۳�ȥMg2+�����ӷ���ʽ��______��
�ܼ��Ca2+��Mg2+��Ba2+�Ƿ����ʱ��ֻ����Ba2+���ɣ�ԭ����______��
(3)�ڶ��ξ���Ҫ��ȥ����I-��IO3-��NH4+��Ca2+��Mg2+������ʾ��ͼ��ͼ��
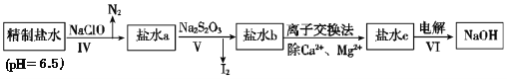
�ٹ��̢���ȥ��������______��
����ˮb�к���SO42-��Na2S2O3��IO3-��ԭΪI2�����ӷ���ʽ��______��
���ڹ��̢������õ�Na2S2O3�׳ƺ�������һ����Ҫ�Ļ���ԭ�ϡ���Ʒ������Ҫ�ɷ���Na2S2O3��5H2OΪ�˲ⶨ�京Na2S2O3��5H2O�Ĵ��ȣ���ȡ8.00 g��Ʒ�����Ƴ�250.0 mL��Һ��ȡ25.00 mL����ƿ�У��μӵ�����Һ��ָʾ��������Ũ��Ϊ0.0500 mol/L�ĵ�ˮ�ζ�(������Ӧ2S2O32-+I2=S4O62-+2I-)���ζ��ﵽ�յ�ʱ��������______���±���¼�ζ������
�ζ����� | �ζ�ǰ����(mL) | �ζ��ζ������(mL) |
��һ�� | 0.30 | 31.12 |
�ڶ��� | 0.36 | 31.56 |
������ | 1.10 | 31.88 |
������Ʒ�Ĵ���Ϊ______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com