
【题目】如图所示为从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是( )

A. 可以选用方案1分离碳酸氢钠中含有的氯化铵
B. 方案1中的残留物应该具有的性质是受热易挥发
C. 方案2中加入的试剂一定能够与除X外的物质发生化学反应
D. 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3
【答案】D
【解析】A项,方案1是将含X的混合物加热得到X,说明是易分解(或易升华)的物质与不易分解的物质分离,而碳酸氢钠和NH4Cl加热都易分解,无法分离碳酸氢钠中含有的氯化铵,故A错误;B项,方案1中采用加热法,使易分解(或易升华)的物质能与不易分解的物质分离,则X物质可能是受热不易分解的固体或难挥发的液体,故B错误;C项,由方案2中过滤操作可知,X以沉淀形式存在,则加入的物质能溶解除X外的其它物质,所以加入的物质可以是水,溶解可溶物,不一定是能够与除X外的物质发生化学反应,故C错误;D项,SiO2能与NaOH溶液反应,而Fe2O3不能与NaOH溶液反应,方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3,故D正确。


科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
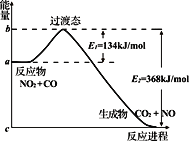
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 100 mL 0.1 mol·L-1 K2SO4溶液中,含有氧原子数为0.04NA
B. 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C. 25 ℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
D. 100 g 17%的氨水中,含有氨分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以Zn和尖晶石型锰酸锌(ZnMn2O4)为电极材料,研制出一种水系锌离子电池。该电池的总反应方程式:xZn + Zn1xMn2O4![]() ZnMn2O4(0 < x < 1)。下列说法正确的是
ZnMn2O4(0 < x < 1)。下列说法正确的是
A. 充电时,Zn2+向ZnMn2O4电极迁移
B. 充电时,阳极反应:ZnMn2O4 2xe—=Zn1-xMn2O4+xZn2+
C. 放电时,每转移1mol e-,ZnMn2O4电极质量增加65g
D. 充放电过程中,只有Zn元素的化合价发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)相同质量的SO2、SO3的物质的量之比为_______,氧原子的个数之比为________。
(2)0.3 mol NH3分子中所含原子数与________个H2O分子中所含原子数相等(NA表示阿佛加德罗常数)。
(3)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为______。
(4)含0.4 mol Al3+的Al2(SO4)3中所含的硫酸根离子的物质的量是__________mol。
(5)100 mL 1.0 mol·L-l 稀硫酸与300 mL 1.0 mol·L-l BaCl2溶液混合,所得溶液中H+ 的物质的量浓度为____(忽略混合时溶液体积的变化).
(6)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl— 的物质的量为____mol.
(7)已知4 mol·L-l 的硫酸溶液密度为ρ1,2 mol·L-l 的硫酸溶液密度为ρ2。100g浓度为4 mol·L-l 的硫酸溶液与____mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含ρ1、ρ2的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂, 不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×l0-8;Ksp(PbCO3)=l.46×l0-13。
回答下列问题:
(1)加Na2CO3溶液转化的目的是_________.
(2)酸溶时,不直接使用H2SO4溶液的原因可能是________;铅与硝酸在酸溶过程中发生反应的离子方程式为__________.
(3)流程中可循环利用的物质是_________;洗涤操作时,检验沉淀是否洗涤干净的方法是________。
(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为_____________。
(5) 50-60℃时合成三盐的化学方程式为______;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com