
【题目】实验室需要0.3 mol·L-1硫酸溶液480 mL。根据这种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是____ (填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。
(2)下列操作中,是容量瓶所具备的功能有__________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.稀释某一浓度的溶液 E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________。
(4)下列操作会使配制的硫酸溶液浓度偏低的是__________。
A.俯视刻度线定容 B.选用的容量瓶内有少量蒸馏水 C.定容摇匀后,液面下降,又加水至刻度线
【答案】BDE 烧杯、玻璃棒 A 8.2 10 将浓硫酸沿烧杯内壁缓慢注入水中,并用玻璃棒不断搅拌 C
【解析】
(1)根据溶液的配制步骤选择需要的仪器;
(2)根据容量瓶的构造和使用分析判断;
(3)先根据c=![]() 计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,根据浓硫酸的体积选取量筒规格,根据浓硫酸稀释时的正确操作解答;
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算,根据浓硫酸的体积选取量筒规格,根据浓硫酸稀释时的正确操作解答;
(4)根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,所以需要的仪器是BDE,还需要的仪器是烧杯和玻璃棒,故答案为:BDE;烧杯、玻璃棒;
(2)A.容量瓶用于配制一定体积的、浓度准确的溶液,故A正确;B.容量瓶只能用来配制一定体积准确浓度的溶液,不能用于贮存溶液,故B错误;C.容量瓶上只有一条刻度线,不能配制或测量容量瓶规格以下的任意体积的液体,故C错误;D.容量瓶不能用来稀释浓溶液,故D错误;E.容量瓶只有一个刻度线,不能量取一定体积的液体,故E错误;F.容量瓶不能受热,故不能用来加热溶解固体溶质,故F错误;故选A;
(3)浓硫酸的浓度c=![]() =
=![]() mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.3mol/L×0.5L,V=0.0082L=8.2mL,选取的量筒规格应该等于或大于量取溶液体积,故选10mL量筒,稀释浓硫酸的正确操作是:将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,防止液体溅出,故答案为:8.2;10;将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌;
mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.3mol/L×0.5L,V=0.0082L=8.2mL,选取的量筒规格应该等于或大于量取溶液体积,故选10mL量筒,稀释浓硫酸的正确操作是:将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,防止液体溅出,故答案为:8.2;10;将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌;
(4)A.俯视刻度线定容,导致溶液的条件偏小,浓度偏大,故A不选;B.选用的容量瓶内有少量蒸馏水,对溶液的体积不会产生影响,所配溶液准确,故B不选;C.定容摇匀后,液面下降,又加水至刻度线,相当于多加了水,溶液的体积偏大,浓度偏低,故C选;故选C。


科目:高中化学 来源: 题型:
【题目】25℃,向20mL 0.1mol·L-1MOH溶液中滴加0.1mol·L-1 CH3COOH溶液,所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是( )
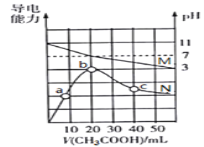
A. MOH是强碱
B. b点溶液中,c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO-)>c(M+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
下列说法错误的是( )
A. 在实验室实施操作①需要的玻璃仪器是漏斗、烧杯、玻璃棒
B. Mg(OH)2―→MgCl2的离子方程式为:Mg(OH)2+2H+===Mg2++2H2O
C. 操作②是将MgCl2溶液蒸干后冷却结晶
D. 操作④阴极和阳极产物的质量比是24∶71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )

A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)写出下列物质在水溶液中的电离方程式:①H2CO3:_______;②NaHCO3:___________。
(2)完成下列反应的离子方程式:①向NaHSO3溶液中加入过量NaHSO4溶液__;②小苏打溶液与乙酸溶液混合___;③FeBr2溶液中通入过量Cl2:____。
(3)25 ℃时,下列各组离子在指定溶液中一定能大量共存的是(______)
A.无色溶液中:Na+、NH4+、Cu2+、SO42-
B.0.1 mol·L-1的NH4HCO3溶液中:K+、SiO32-、AlO2-、Cl-
C.25 ℃时,Kw/c(H+)=1×10-2 mol·L-1的溶液中:K+、NO3-、S2-、ClO-
D.使甲基橙呈红色的溶液中:NH4+、Ba2+、Al3+、Cl-
(4)200 mL某溶液中有5种离子大量共存,其中4种离子的物质的量如下表:
离子 | H+ | K+ | NO3- | SO42- |
物质的量(mol) | 0.5 | 0.1 | 0.6 | 0.15 |
则另外一种离子是________(填写代号),该离子的浓度为________。
A.Fe2+ B.Cl- C.Al3+ D.ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
A. υ(A)=0.2mol/(L·min) B. υ(B)=0.9mol/(L·min)
C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、 101kP下,1g硫粉完全燃烧放出9kJ的热量,写出表示该反应燃烧热的热化学方程式为__________________________
(2)Cl2和H2O(g))通过灼热的炭层,生成HCl和CO2,当有2mol电子转移时反应释放出145kJ热量,写出该反应的热化学方程式:___________________________ .
(3)已知拆开1molH-H键,1molCl-Cl键,1molH-Cl键,分别需要的能量是436kJ、243kJ、431kJ,则Cl2与H2反应生成HCl的热化学方程式为 _______________________。
(4)已知:C(s)+O2(g) = CO2(g) ΔH=-393 kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1
写出碳和氧气生成一氧化碳的热化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)![]() cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )

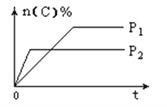
A. 升高温度,平衡向正反应方向移动 B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a<c+d D. 根据图象无法确定改变温度后平衡移动方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com