
 ”和画“×”分别标明B和N的相对位置.
”和画“×”分别标明B和N的相对位置.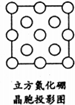
分析 (1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式;原子轨道中电子处于半满、全满、全空时最稳定;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键;
能形成分子间氢键的物质熔沸点较高;
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式,B与N之间形成配位键,氮取子提供孤电子对;
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
立方氮化硼中,晶胞边长为361.5pm=361.5×10-10cm,晶胞体积=(361.5×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$;
(5)如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用.
解答 解:(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;
能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3•NH3.在BF3•NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式为sp3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,
故答案为:sp3;孤电子对;
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为分子间作用力;
立方氮化硼中,晶胞边长为361.5pm=361.5×10-10cm,晶胞体积=(361.5×10-10cm)3,该晶胞中N原子个数8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{25}{{N}_{A}}×4}{(365.1×1{0}^{-10})^{3}}$g/cm3=$\frac{4×25}{(361.5×1{0}^{-10})^{3}NA}$g/cm3,
故答案为:分子间作用力;$\frac{4×25}{(361.5×1{0}^{-10})^{3}NA}$.
(5)如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用,所以其图为 ,故答案为:
,故答案为: .
.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、配位键及氢键、原子核外电子排布等知识点,难点是晶胞计算及(5)题,采用三视图确定N原子和B原子位置关系,题目难度中等,侧重考查学生空间想象能力及计算能力.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
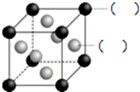 A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题:
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 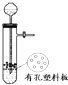 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 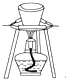 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 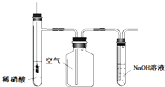 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 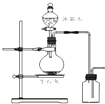 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
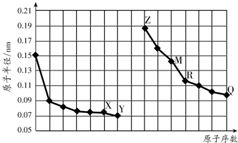
| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
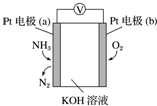 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
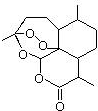
 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)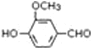 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: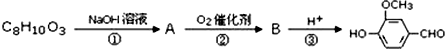
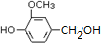 .
.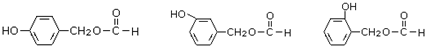 .
.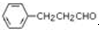 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).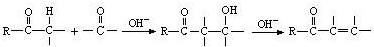
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
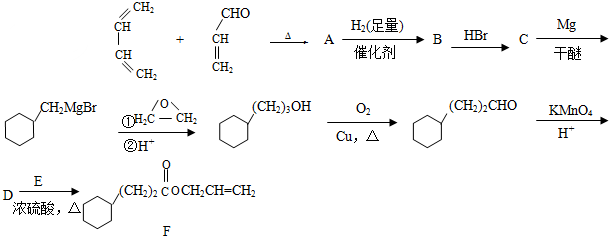
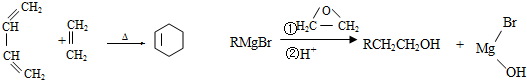
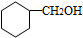 .
.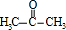 .
. .
.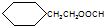
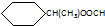 .
.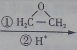 CH3CH2CH2CH2OH(其他试剂任选).
CH3CH2CH2CH2OH(其他试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com