
 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )| A. | ①②③⑤ | B. | ①②⑥ | C. | ③⑤⑥ | D. | ②③⑤ |
分析 浓硫酸具有强氧化性,在加热条件下可与铜反应;浓硫酸具有吸水性,可使胆矾失去结晶水;浓硫酸具有脱水性,能够使滤纸变黑;浓硝酸具有强氧化性,在常温下与铁发生钝化;浓硝酸与蛋白质发生显色反应;浓硝酸具有酸性和强氧化性,遇到石蕊先变红色,后退色.
解答 解:①浓硫酸与铜在加热条件下反应,不加热无现象,故①错误;
②浓硫酸具有吸水性,可使胆矾失去结晶水,颜色变浅,故②正确;
③浓硫酸具有脱水性,能够使滤纸变黑,故③正确;
④浓硝酸具有强氧化性,在常温下与铁发生钝化,不能观察到绿色,故④错误;
⑤浓硝酸与蛋白质发生显色反应,蛋白质变黄,故⑤正确;
⑥浓硝酸具有酸性和强氧化性,遇到石蕊先变红色,后退色,故⑥错误;
故选:D.
点评 本题考查浓硫酸和浓硝酸的性质,熟悉浓硫酸、浓硝酸特性是解题关键,注意浓硫酸、浓硝酸与到铁在常温下发生钝化.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
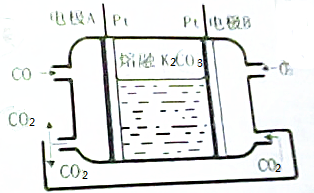
 氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:
氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现有0.001000mol/L酸性KMnO4溶液和10.00mL未知浓度的无色NaHSO3溶液,反应的离子方程式是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:用药匙取少许样品于试管中,用滴管滴加适量的3mol•L-1H2SO4溶液,加热,充分反应后得到A溶液 | - |
| 步骤2:取2mLA溶液于试管中,用胶头滴管滴加1~2滴20%KSCN溶液,振荡试管 | 若溶液变红色,样品中含+3价的铁元素 |
| 步骤3:另取2mLA溶液于试管中,用胶头滴管滴加1~2滴0.01mol•L-1KMnO4溶液,振荡试管 | 若溶液的紫红色褪去,样品中含+2价的铁元素 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时,Cu2++2HS-═CuS↓+H2S↑ | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )与乙烯通过烯烃复分解进行如图所示的一系列反应:
)与乙烯通过烯烃复分解进行如图所示的一系列反应: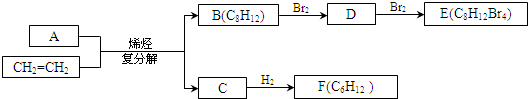
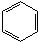 $\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式
$\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式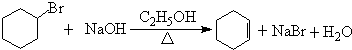

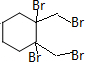 +4KOH
+4KOH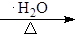
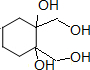 +4KBr.
+4KBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.
;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式NCl3+3H2O=NH3+3HClO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
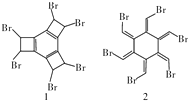
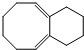
| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
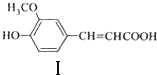 的说法,正确的是AB.
的说法,正确的是AB.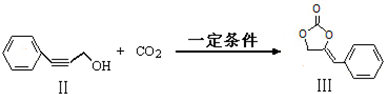
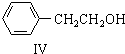 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$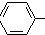 CH2CH2
CH2CH2 -CH2CH3+H2O
-CH2CH3+H2O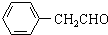 ;
;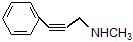 也可以和CO2发生类似反应①的反应,生成由VI,VI的结构简式为
也可以和CO2发生类似反应①的反应,生成由VI,VI的结构简式为 .
. .
.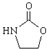 ,涉及的反应方程式为HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$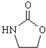 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com