
【题目】下表是元素周期表的一部分,根据要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
2 | E | H | F | I | ||||
3 | A | C | D | G | R | |||
4 | B |
(1)十种元素中化学性质最不活泼的元素是________(填元素符号)。
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是________(填化学式)。
(3)I元素跟A元素形成化合物的是_____(离子或共价)化合物。并用电子式表示该化合物的形成过程_____
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是__________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式 ______________。
【答案】Ar NaOH 离子 ![]() Cl2+2OH-=Cl-+ClO-+H2O 2Na2O2+2CO2=2Na2CO3+O2
Cl2+2OH-=Cl-+ClO-+H2O 2Na2O2+2CO2=2Na2CO3+O2
【解析】
根据元素在周期表中的位置可知,A为Na、B为K、C为Mg、D为Al、E为C、H为N、F为O、I为F、G为Cl、R为Ar,据此回答。
(1)稀有气体Ar原子最外层电子数为8,为稳定结构,化学性质最稳定,故答案为:Ar;
(2)同周期元素随着原子序数增大金属性逐渐减弱,则金属性Na>Mg>Al,金属性越强最高价氧化物对应的水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;
(3)I元素跟A元素形成化合物为NaF,由钠离子与氟离子构成,为离子化合物,该化合物的形成过程用电子式表示为:![]() ,故答案为:离子;
,故答案为:离子;![]() ;
;
(4)G的单质为Cl2,B的最高价氧化物对应水化物为KOH,故反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)元素A 为Na,F为O,形成的两种化合物为Na2O、Na2O2,其中较稳定的化合物为Na2O2,Na2O2与CO2反应的方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】常见的有机物A、B、C、D、E、F间的转换关系如图所示(以下变化中,某些反应条件及产物未标明)。B是天然有机高分子化合物,C、D可发生银镜反应。

(1)B的分子式为_______________;F的结构简式为_________。
(2)E中官能团的名称是____________。
(3)A的同分异构体的结构简式是_____________。
(4)A→D反应的化学方程式:__________。
(5)D→E反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B两种烃为原料,合成治疗高血脂药物M的路线如下图所示(部分反应条件和试剂略去):
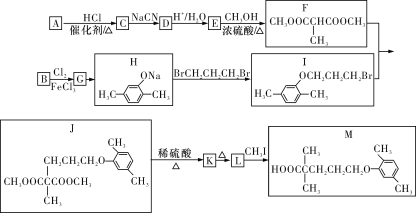
已知:①A的密度是同条件下H2密度的13倍;
②RCl![]() RCN
RCN![]() RCOOH(R表示烃基);
RCOOH(R表示烃基);
③CCOOHCOOHR1R2![]() R1CHCOOHR2(R1和R2表示烃基)。
R1CHCOOHR2(R1和R2表示烃基)。
请回答下列问题:
(1)B的化学名称为_____________,E中官能团的名称为_____________。
(2)A→C的反应类型为_____________。M分子的核磁共振氢谱中有________组吸收峰。
(3)J→K的化学方程式为_____________。
(4)有机物N比L少三个“CH2”基团,同时满足下列条件的N的同分异构体有_______种(不考虑立体异构)。
①苯环上有两个取代基;
②能与FeCl3溶液发生显色反应;
③能与NaHCO3溶液反应生成CO2。
(5)参照上述合成路线和信息,以CClClCH3CH3和乙醇为原料(无机试剂任选),设计制备2-甲基丙酸乙酯的合成路线:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+ =2 Ag +Cu2+ ”设制一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______,发生_________反应(填“氧化”或“还原”),电解质溶液是_______;
(2)若导线上转移电子1 mol,则生成银___________克。
如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置。请你回答下列问题:

(3)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:___________。
(4)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置___________(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O42H2O)无色,易溶于水,熔点为101℃(失水后能升华),170℃以上分解。其钠、钾、铵盐均易溶于水,而钙盐难溶于水。某实验探究小组对草酸晶体进行加热,并验证其分解产物。
(1)加热草酸晶体最适宜选用下图中的_______(填装置编号),不选其它装置的原因是 _________。
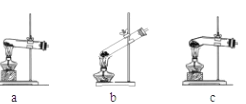
(2)若将产生的气体直接通入澄清石灰水来检验分解产物中是否含CO2,请你评价正确与否并作简要的解释___________。
(3)用下图装置检验草酸的分解产物H2O(g)、CO2和CO.将这种混合气体依次通过___________(填装置中接口的字母,可重复使用)。
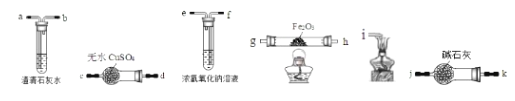
(4)能否依据硬质玻璃管Fe2O3质量的减轻来计算分解产生CO的量?_____。假设硬质玻璃管中所装为铁氧化物的混合物,可能是FeO、Fe2O3、Fe3O4的任意组合,现取ag混合物充分反应后,质量减轻了8a/29克,通过计算确定该混合物中三种氧化物的物质的量的关系为____。
(5)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:_______。
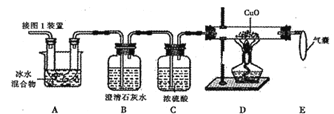
(6)有同学设计下图装置来证明Fe2O3反应后的固体中含有单质铁,你认为可行吗?____,其原因是:_______;图中安全漏斗的作用是____________________。
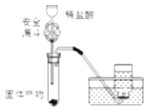
(7)设计一个简单的实验证明草酸是弱酸:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1体积CH4和4体积Cl2组成的混合气体充入大试管中。
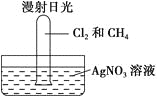
将此试管倒立在盛有AgNO3溶液的水槽中,放在光亮处,片刻后发现试管壁上有油状液滴出现,该油状液滴可能是________,水槽中还观察到________,原因是________(用离子方程式解释)。若向水槽中再滴入几滴紫色石蕊试液又观察到________,原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-5 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)25 ℃时,在某二元酸 H2A 溶液中存在的所有微粒为:H+、OH-、HA-、A2-、H2O,写出 H2A 的 电离方程式_____。
(2)25 ℃时,在 0.5 mol·L-1 的醋酸溶液中由醋酸电离出的[H+]约是_________,是该溶液 中由水电离出的[H+]的_____倍,醋酸的电离度为_____(填百分数)
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______________________________。
(4)25 ℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中[CH3COO-]-[Na+]=_____(填准确数值)。
(5)25 ℃时,将 a mol·L-1 的醋酸与 b mol·L-1 氢氧化钠溶液等体积混合,反应后溶液恰好显中性, 用 a、b 表示醋酸的电离常数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4A+2B![]() 3C,下列说法中正确的是
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com