
【题目】如图中A~J分别代表相关反应的一种物质,图中有部分生成物未标出.
已知:A分解得到等物质的量的B,C,D;反应①为:2Mg+CO2 ![]() 2MgO+C.
2MgO+C.
(1)A的化学式 .
(2)写出反应②的化学方程式: .
(3)写出反应③的离子方程式: .
(4)写出反应⑤的化学方程式: .
(5)在反应④中,当生成标准状况下2.24L G时,转移电子mol.
【答案】
(1)NH4HCO3
(2)4NH3+5O2 ![]() ?4NO+6H2O
?4NO+6H2O
(3)NH4++HCO3﹣+2OH﹣ ![]() ?NH3↑+CO2 ↑+2H2O
?NH3↑+CO2 ↑+2H2O
(4)C+4HNO3(浓) ![]() ?CO2↑+4NO2↑+2H2O
?CO2↑+4NO2↑+2H2O
(5)0.2
【解析】解:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成D,则A为酸式盐或铵盐,C能和过氧化钠反应,则C为水或二氧化碳,镁条能在B中燃烧,则B为二氧化碳或氧气,因为A受热分解生成B、C、D,则B为二氧化碳,C为水,水和过氧化钠反应生成NaOH和O2 , D能在催化剂条件下反应生成H,则D是NH3 , G是O2 , H是NO,I是NO2 , J是HNO3 , 镁和二氧化碳反应生成氧化镁和碳,C和浓硝酸反应生成二氧化碳、二氧化氮和水,则E是MgO,F是C,通过以上分析知,A为NH4HCO3 ,
(1.)由上分析知A为NH4HCO3 , 所以答案是:NH4HCO3;
(2.)②在催化剂、加热条件下,氨气被氧化生成一氧化氮和水,反应方程式为:4NH3+5O2 ![]() 4NO+6H2O,所以答案是:4NH3+5O2
4NO+6H2O,所以答案是:4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(3.)在加热条件下,碳酸氢铵和氢氧化钠反应生成氨气、二氧化碳和水,离子方程式为:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO2 ↑+2H2O,
NH3↑+CO2 ↑+2H2O,
所以答案是:NH4++HCO3﹣+2OH﹣ ![]() NH3↑+CO2 ↑+2H2O;
NH3↑+CO2 ↑+2H2O;
(4.)反应⑤为碳在浓硝酸中加热反应,方程式为C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O,所以答案是:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,所以答案是:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(5.)水和过氧化钠反应生成氢氧化钠和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,当生成标况下2.24L 氧气时转移电子的物质的量= ![]() =0.2mol,所以答案是:0.2.
=0.2mol,所以答案是:0.2.


科目:高中化学 来源: 题型:
【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10﹣11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是( )
A.浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 molL﹣1的AgN03溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C.0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Na、Mg、S、Br是常见的六种元素.
(1)Br位于元素周期表第周期第族;Na和O形成1:1的化合物的电子式: . 该物质含有的化学键为: .
(2)用“>”或“<”填空:
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣Mg2+ | SO3 | H﹣O |
(3)已知多硫化钠一溴储能电池是一种二次电池,结构如图.电池总反应为:2Na2S3+2NaBr ![]() 3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
3Na2S2+Br2①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:
(4)已知N4为正四面体结构,N﹣N键能为167kJmol﹣1 , N≡N键能为942kJmol﹣1 . 写出N4(g)转化为N2(g)的热化学方程式 . 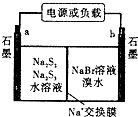
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要200mL2.0mol/L的碳酸钠溶液.请回答下列有关问题:
(1)实验中,下列仪器不必使用的是 (填写字母).
A.250mL容量瓶
B.洗瓶
C.托盘天平(药匙)
D.烧瓶
E.玻璃棒
(2)除上述仪器外,尚缺少的仪器或用品有、 .
(3)容量瓶上,除有刻度和容量规格外还应标注 . 容量瓶在使用前必须进行的实验操作是 .
(4)配制过程一般包括:计算、称量、溶解、转移、洗涤、定容、摇匀等步骤,其中所缺的关键步聚是 , 应在之后,之前.
(5)实验评价:
①若配制过程中,向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,对实验结果有何影响?(填写:偏大、偏小或不影响)
②若在滴加蒸馏水时,不慎超过刻度线,应如何处理? .
(6)计算:所需碳酸钠的质量.(要有过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程. 【实验】在0.1molL﹣l MgSO4 , 0.05molL﹣l﹣Al2( SO4)3的混合溶液中滴加0.5mol.L﹣1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.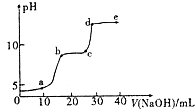
(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于(填仪器名称)中滴加.
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 .
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3: 推测l:生成Mg( OH)2沉淀,消耗OH ﹣;
推测2:;
推测3.
若推测l符合实际情况,则a点之前反应的离子方程式为一,请据此描述Mg( OH)2 , A1( OH)3两种物质在水溶液中溶解性的差异.
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是。
(2)溶液中通入Cl2时发生反应的化学方程式是,反应中Cl2表现出的性质是,此处的Cl2也可以用代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3 , 可向FeCl3溶液中滴加足量 , 然后过滤、洗涤、 , 即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是,反应一段时间后,取少量腐蚀液,向其中滴加 , 观察到 , 证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32﹣、SO32﹣、SO42﹣、Cl﹣中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是( )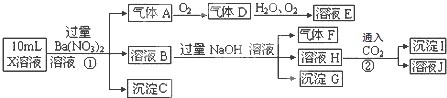
A.X中肯定存在Fe2+、NH4+、SO42﹣
B.溶液E和气体F不能发生化学反应
C.X中肯定不存在CO32﹣、SO32﹣、Cl﹣
D.沉淀I是Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法中,正确的是( )
A.标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA
B.常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA
C.标准状况下,2.24 L NH3中含有共价键的数目为NA
D.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com