
����Ŀ��������ĸ��ֻ��������ճ����������Ź㷺Ӧ�ã�������ѧ֪ʶ�ش��������⣺
��1����֪1g H2S������ȫȼ�գ�����Һ̬ˮ�Ͷ����������壬�ų�17.24kJ��������д��H2S����ȼ���ȵ��Ȼ�ѧ��ʽ�� ��
��2����֪��������NaHSO3��Һ��c��H2SO3 ����c��SO32���� ��H2SO3 �ĵ���ƽ�ⳣ��Ϊ��K1=1.5��10��2 K2=1.1��10��7����ˮ�ĵ���ƽ�ⳣ��ΪK=1.8��10��2�� ��i��������ʵ���Ũ�ȵ�����������Һ����NH3H2O ��KHSO3����KHCO3 ��Һ��ˮ�ĵ���̶��ɴ�С����˳��Ϊ
��ii��0.1molL��1��NaHSO3��Һ��C��H+��C��OH����������������������=������
��3����֪25��ʱKsp[Cu��OH��2]=2.2��10��20 �� Ksp[Fe��OH��2]=8.0��10��16 �� KspFe��OH��3]=4.0��10��38 �� Ksp[Al��OH��3]=1.1��10��33��i����25���£���Ũ�Ⱦ�Ϊ0.1mol/L��AlCl3��CuCl2�����Һ����μ��백ˮ���������������ѧʽ����
��ii����1.0mol Fe2��SO4��3��1.0mol FeSO4��1L���Ի����Һͨ��NH3 �� ������Һ��PHΪ3ʱ��������Һ��c��Fe2+����c��Fe3+��= ��
���𰸡�
��1��H2S��g��+ ![]() O2��g��=SO2��g��+H2O��l����H=��586.16 kJ?mol��1
O2��g��=SO2��g��+H2O��l����H=��586.16 kJ?mol��1
��2���ۣ��ڣ��٣���
��3��Al��OH��3��2.5��104
���������⣺��1��1gH2S�����ʵ���Ϊn= ![]() =
= ![]() =
= ![]() mol��ȼ������Һ̬ˮ�Ͷ�����������ʱ����17.24KJ����1molH2Sȼ�շ���586.16KJ�����Ȼ�ѧ����ʽΪ��H2S��g��+
mol��ȼ������Һ̬ˮ�Ͷ�����������ʱ����17.24KJ����1molH2Sȼ�շ���586.16KJ�����Ȼ�ѧ����ʽΪ��H2S��g��+ ![]() O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1 �� ���Դ��ǣ�H2S��g��+
O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1 �� ���Դ��ǣ�H2S��g��+ ![]() O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1����2����i����NH3H2OΪ���������ˮ�ĵ��룬��Һ��������Ũ��С��c����ˮ�ĵ������Ƴ̶Ⱥܴ�KHSO3������Һ�е���������������ԣ����Ƶ�ˮ�ĵ��룬��Һ��������Ũ��ԶС��c����ˮ�ĵ�������Ƴ̶Ƚ�С����KHCO3����Һ��ˮ���Լ��ԣ��ٽ���ˮ�ĵ��룻����������Һ��ˮ�ĵ���̶��ɴ�С����Ϊ���ۣ��ڣ��٣����Դ��ǣ��ۣ��ڣ��٣���ii������NaHSO3��Һ�мȴ��ڵ���ƽ���ִ���ˮ��ƽ�⣺HSO3��H++SO32����HSO3��+H2OOH��+H2SO3 �� HSO3���ĵ���ƽ��̶ȴ�����ˮ��ƽ��̶ȣ�����Һ�����ԣ�C��H+������C��OH���������Դ��ǣ����� ��3����i������Al��OH��3��Cu��OH��2���ܶȻ���������25���£���Ũ�Ⱦ�Ϊ0.1molL��1��AlCl3��CuCl2�����Һ����μ��백ˮ��
O2��g��=SO2��g��+H2O��l����H=��586.16 kJmol��1����2����i����NH3H2OΪ���������ˮ�ĵ��룬��Һ��������Ũ��С��c����ˮ�ĵ������Ƴ̶Ⱥܴ�KHSO3������Һ�е���������������ԣ����Ƶ�ˮ�ĵ��룬��Һ��������Ũ��ԶС��c����ˮ�ĵ�������Ƴ̶Ƚ�С����KHCO3����Һ��ˮ���Լ��ԣ��ٽ���ˮ�ĵ��룻����������Һ��ˮ�ĵ���̶��ɴ�С����Ϊ���ۣ��ڣ��٣����Դ��ǣ��ۣ��ڣ��٣���ii������NaHSO3��Һ�мȴ��ڵ���ƽ���ִ���ˮ��ƽ�⣺HSO3��H++SO32����HSO3��+H2OOH��+H2SO3 �� HSO3���ĵ���ƽ��̶ȴ�����ˮ��ƽ��̶ȣ�����Һ�����ԣ�C��H+������C��OH���������Դ��ǣ����� ��3����i������Al��OH��3��Cu��OH��2���ܶȻ���������25���£���Ũ�Ⱦ�Ϊ0.1molL��1��AlCl3��CuCl2�����Һ����μ��백ˮ�� ![]() ��
�� ![]() �����Լ�����ͬ��Ũ�ȵİ�ˮ��Al��OH��3�������������Դ��ǣ�Al��OH��3����ii��pHΪ3ʱ��c��OH����=10��11mol/L����1.0mol FeSO4��Һ��c��Fe2+����c2��OH����=10��22��8.0��10��16 �� û�г������ɣ���c��Fe2+��=1.0mol/L����Ksp��Fe��OH��3��=4.0��10��38��֪��c��Fe3+��=
�����Լ�����ͬ��Ũ�ȵİ�ˮ��Al��OH��3�������������Դ��ǣ�Al��OH��3����ii��pHΪ3ʱ��c��OH����=10��11mol/L����1.0mol FeSO4��Һ��c��Fe2+����c2��OH����=10��22��8.0��10��16 �� û�г������ɣ���c��Fe2+��=1.0mol/L����Ksp��Fe��OH��3��=4.0��10��38��֪��c��Fe3+��= ![]() mol/L=4��10��5mol/L����c��Fe2+����c��Fe3+��=1��4��10��5=2.5��104�����Դ��ǣ�2.5��104 ��
mol/L=4��10��5mol/L����c��Fe2+����c��Fe3+��=1��4��10��5=2.5��104�����Դ��ǣ�2.5��104 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ[Mg��ClO3��2]����������������ݼ��ȣ�ʵ�����Ʊ�����Mg��ClO3��26H2O��������ͼ1�� 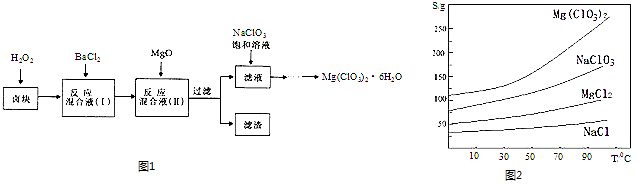
��֪����±����Ҫ�ɷ�ΪMgCl26H2O������MgSO4��FeCl2�����ʣ�
�����ֻ�������ܽ�ȣ�S�����¶ȣ�T��
�仯������ͼ2��ʾ���ش��������⣺
��1������ʱ��Ҫ�IJ��������� ��
��2������BaCl2��Ŀ���dz�ȥ�������ӣ������ѳ�����ȫ�ķ����� ��
��3������±����H2O2��Һ���ܽ�Ĵ�ʩ�У���д��һ�����ɣ�
��4������MgO���������� ��������Ҫ�ɷ�Ϊ ��
��5������Һ�м���NaClO3������Һ������Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaClO3=Mg��ClO3��2��+2NaCl���ٽ�һ����ȡMg��ClO3��26H2O��ʵ�鲽������Ϊ�����ڳ��ȹ��ˣ������ܹ��ˡ�ϴ�ӡ����
��6����Ʒ��Mg��ClO3��26H2O�����IJⶨ�� ����1��ȷ����3.50g��Ʒ���100mL��Һ��
����2��ȡ10.00mL����ƿ�У�����10.00mLϡ�����20.00mL 1.000molL��1��FeSO4��Һ���ȣ�
����3����ȴ�����£���0��l000molL��1K2Cr2O7��Һ�ζ�ʣ���Fe2+���յ㣬�˹����з�Ӧ�����ӷ���ʽΪ��Cr2O72��+6Fe2++14H+=2Cr3++6Fe3++7H2O��
����4��������2��3�ظ����Σ������ƽ������K2Cr2O7��Һ15.00mL��
����д������2�з�����Ӧ�����ӷ���ʽ����ԭ����ΪCl����
�ڲ�Ʒ��Mg��ClO3��26H2O����������Ϊ �� ��������������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������н��еĸ���Ӧ�У��ڷ�Ӧ�����м������Ӽ������Լ����Ǽ��Լ����ѣ��������Ӽ������Լ����Ǽ��Լ����ɵ���
A��2NaBr+Cl2=2NaCl+Br2 B��2AgOH=Ag2O+H2O
C��2Na+2H2O=2NaOH+H2�� D��2Na2O2+2H2O=4NaOH+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH=4�������pH=10�İ�ˮ�������Ϻ�������Һ��pHֵ
A. һ��С��7 B. һ������7 C. һ������7 D. ���ж�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ǻ�ѧ�о��Ļ������������и�ʵ��װ��ͼ�������У�������ǣ�������
A.װ�âٿ����ڼ��װ�õ�������
B.װ�âڿ����ڳ�ȥCO�л��е�����CO2
C.װ�âۿ����ڰ�ȫ���ռ�������ˮ���Ȼ�����������
D.װ�âܿ������ſ����ռ�CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ѷ���һ�����͵����ӣ��仯ѧʽΪN5 �� ����ͬ�¶ȡ�ѹǿ�µ�������N5��N2������ͬ�ģ�������
A.������
B.���
C.ԭ����
D.�ܶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.05mol Na2CO3��������ˮ���100mL��Һ������Һ�м����������ʣ��йؽ�����ȷ���ǣ� ��
��������� | ���� | |
A | 50mL 1mol/L H2SO4 | ��Ӧ������c��Na+��=c��SO42���� |
B | 0.5mol CaO | ��Һ�� |
C | 50mL H2O | ��ˮ�������c��H+��c��OH�������� |
D | 0.1mol NaHSO4���� | ��Ӧ��ȫ����ҺpH��С��c ��Na+������ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��У�λ�ڽ���Ԫ����ǽ���Ԫ�صķֽ��߸�����һЩԪ�ؿ���������()
A. �Ͻ�B. ũҩC. �뵼��D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A. ���ӻ�����һ���������ۼ�
B. ���ۻ�������һ�����������Ӽ�
C. ��̬���ʵķ�����һ�����ڹ��ۼ�
D. �ǽ���Ԫ�صĻ�������һ���������Ӽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com