
| A. | 电负性:④>③>②>① | B. | 最高正化合价:③>①>②>④ | ||
| C. | 原子半径:①>②>③>④ | D. | 第一电离能:④>③>②>① |
分析 现有①、②、③三种元素的基态原子的电子排布式如下:①1s22s22p63s2; ②1s22s22p63s23p1;③1s22s22p3;④1s22s22p4,在原子中原子核外电子数=核内质子数=原子序数,根据原子核外电子排布式知,①②③④原子序数分别是12、13、7、8,所以分别是Mg、Al、N、O元素;
A.元素的非金属性越强,其电负性越强,其金属性越强,其电负性越小;
B.主族元素其最高正化合价等于其族序数(O、F元素除外);
C.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,其第一电离能随着原子序数增大而减小.
解答 解:现有①、②、③三种元素的基态原子的电子排布式如下:①1s22s22p63s2; ②1s22s22p63s23p1;③1s22s22p3;④1s22s22p4,在原子中原子核外电子数=核内质子数=原子序数,根据原子核外电子排布式知,①②③④原子序数分别是12、13、7、8,所以分别是Mg、Al、N、O元素;
A.元素的非金属性越强,其电负性越强,其金属性越强,其电负性越小,金属性Mg>Al,非金属性O>N,则电负性:④>③>②>①,故A正确;
B.主族元素其最高正化合价等于其族序数(O、F元素除外),O元素没有正化合价,所以其最高正化合价为:③>①>②>④,故B正确;
C.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径:①>②>③>④,故C正确;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,其第一电离能随着原子序数增大而减小,所以第一电离能:③>④>①>②,
故D错误;
故选D.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生判断及元素周期律的灵活运用,正确判断元素、明确元素周期律内涵是解本题关键,注意第一电离能规律中的反常现象,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 常温下,与水反应,A浮于水面而B却沉于水底 | |
| C. | 常温时,A能从酸中置换出氢,而B却不能 | |
| D. | 等物质的量的A、B分别从足量酸中置换生成H2:A比B的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ag+、NO3-、MnO4 - | B. | Fe3+、Fe2+、SO42-、Cl- | ||
| C. | K+、Na+、AlO2-、CO32- | D. | Al3+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
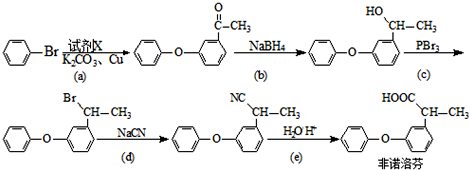
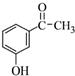 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Z(OH)n为强碱,则W(OH)m也一定为强碱 | |
| B. | 若HnXOm为强酸,则Z的气态氢化物溶于水一定显酸性 | |
| C. | Z可以从W的盐溶液中将W置换出来 | |
| D. | 若Z的最高正价为+3价,则W的氢化物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液和醋酸铵溶液均显中性,两溶液中水的电离程度也相同 | |
| B. | 84消毒液(含NaClO)产生消毒作用的离子反应为CO2+H2O+ClO-=HClO+HCO3- | |
| C. | 在硫化钠稀溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| D. | 25℃时,将0.1mol•L-1氢氧化钠溶液与0.06mol•L-1硫酸溶液等体积混合,该混合溶液的pH等于2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | Na2O与水反应:O2-+H2O═2OH- | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com