
【题目】A、B为短周期元素,A原子的第二电子层比B原子的第二电子层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为
A.B3A2B.BA2C.AB4D.B2A3
科目:高中化学 来源: 题型:
【题目】(1)取300 mL 0.2 mol/L的KI溶液与一定量的酸性 KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量为________________________。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,又变为棕黄色的原因用离子方程式解释________________________________________。
(3)在1 L FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有1/4的 Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)三氟化氮(NF3)是一种无色、无臭的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请写出该反应的化学方程式_________________________________________,反应中生成0.2 mol HNO3,转移的电子数目为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伪麻黄碱(I)是常见感冒药的成分之一,用于缓解感冒时带来的一些症状,其中一种合成路线如下:

已知:I.![]() (R、R'均代表烃基或氢原子)
(R、R'均代表烃基或氢原子)
II.A是衡量一个国家石油化工发展水平的重要标志之一;D的蒸气密度是相同条件下氢气密度的53倍。
回答下列问题:
(1)D的名称为_________________。F分子中最多有____________个原子在同一个平面上。
(2)I中含氧官能团的名称为_________________。H的结构简式为_________________。
(3)写出E在一定条件下与乙酸反应的化学方程式:_________________。
(4)G可以发生消去反应得到化合物M。写出M在一定条件下发生聚合反应的化学方程式:_________________。
(5)满足下列条件的E的同分异构体有____________种(不考虑立体异构)。
①属于苯的邻位二元取代物
②能与金属钠反应
(6)参照上述合成路线和相关信息,设计由A制备2-丁醇的合成路线(其他试剂任选):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸溶液,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0 ℃、101 kPa条件下的H2体积为44.8 mL),在该温度下,下列说法不正确的是( )
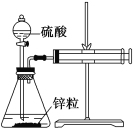
A. 用锌粒来表示10 s内该反应的速率为0.013 g/s
B. 忽略锥形瓶内溶液体积的变化,用H+来表示10 s内该反应的速率为0.01 mol/(L·s)
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内该反应的速率为0.01 mol/(L·s)
D. 用H2来表示10 s内该反应的速率为0.000 2 mol/s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列制备物质的工业生产流程合理的是
A. 由铝土矿冶炼铝:铝土矿![]() Al
Al
B. 制硫酸:硫铁矿![]() SO2
SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
C. 由NaCl制漂白粉:NaCl(aq)![]() Cl2
Cl2![]() 漂白粉
漂白粉
D. 合成NH3:NH4Cl和Ca(OH)2固体![]() NH3
NH3![]() 纯净干燥的氨气
纯净干燥的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为__________________;得到滤渣1的主要成分为______(写化学式)。
(2)第②步加H2O2的作用是______________________(用离子方程式表示);使用H2O2的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) △H=-48.40kJ·mol-1
B. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-5518kJ·mol-1
C. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
D. C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) △H=-48.40kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com