
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
分析 (1)Al和氧化铁在高温下发生铝热反应生成氧化铝和Fe;
(2)该反应是放热反应而使Fe熔化,且Al的熔点比Fe的低;
(3)Fe能被磁铁吸引;
(4)Al能溶于NaOH溶液且生成氢气;
(5)混合物和硫酸反应生成硫酸盐,溶液中还有剩余的硫酸,所以溶液中的溶质是硫酸盐和硫酸,加入碱后使溶液中铝离子恰好生成沉淀,则原来溶液中的金属阳离子完全转化为氢氧化物,根据电荷守恒知,硫酸根离子所带电荷等于氢氧根离子所带电荷,根据电荷守恒计算硫酸物质的量浓度.
解答 解:(1)Al和氧化铁在高温下发生铝热反应生成氧化铝和Fe,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)该反应是放热反应而使Fe熔化,且Al的熔点比Fe的低,所以生成的是铝铁合金,故答案为:铝的熔点比铁的低;
(3)Fe能被磁铁吸引,所以最简单的办法是用磁铁吸引,如果能吸引,说明有铁生成,
故答案为:用磁铁吸引,如果能吸引,说明有铁生成;
(4)Fe、Al、Fe2O3、Al2O3中只有Al能溶于NaOH溶液且生成氢气,向溶液中加入NaOH溶液,根据固体是否溶解且生成氢气判断是否含有Al,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)混合物和硫酸反应生成硫酸盐,溶液中还有剩余的硫酸,所以溶液中的溶质是硫酸盐和硫酸,加入碱后使溶液中铝离子恰好生成沉淀,则原来溶液中的金属阳离子完全转化为氢氧化物,根据电荷守恒知,硫酸根离子所带电荷等于氢氧根离子所带电荷,根据电荷守恒得c(H2SO4)=$\frac{\frac{6mol/L×0.2L×1}{2}}{0.15L}$=4mol/L,
故答案为:4mol/L.
点评 本题以铝及其化合物为载体考查混合物的计算、铝热反应等知识点,涉及计算、物质的鉴定等知识点,Fe可以用物理或化学方法鉴定,难点是(5)题,注意根据电荷守恒进行计算能化繁为简,提高解答效率,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金属的冶炼、电镀、燃料的燃烧、食物的腐败、钢铁的锈蚀等均属于氧化还原反应 | |
| B. | 将铁片投入硫酸铜溶液中所发生的置换反应既属于氧化还原反应,又属于离子反应 | |
| C. | 有单质参与的化学反应一定是氧化还原反应 | |
| D. | 氧化还原反应一定发生电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物一定含有C元素 | |
| B. | 能够写出电离方程式的物质在书写离子方程式中一定可以拆 | |
| C. | 有机物中不可能含有金属元素 | |
| D. | AlCl3 属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题:
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: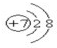 ,元素D位于元素周期表的第ⅥA族.
,元素D位于元素周期表的第ⅥA族. +2
+2 →
→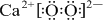 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
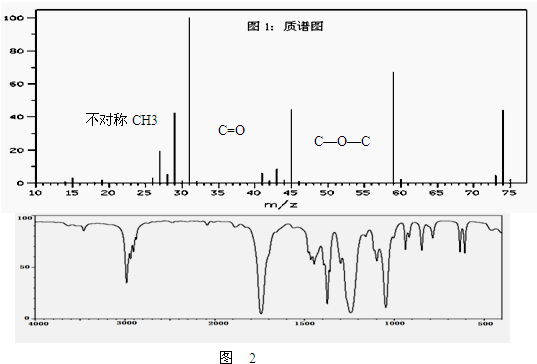
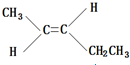 、
、 、
、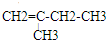 、
、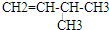 .
.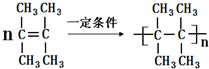 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | 元素性质或原子结构 |
| X | 形成的简单阳离子核外无电子 |
| Y | 元素的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应 |
| Z | 元素在周期表的族序数等于周期序数的3倍 |
| T | 同周期元素中形成的简单离子半径最小 |
| A. | 原子半径大小顺序:T>Z>Y>X | |
| B. | 常温下,T的单质与Y的最高价氧化物对应水化物的浓溶液反应生成氢气 | |
| C. | X分别与Y、Z均可形成既含极性键又含非极性键的化合物 | |
| D. | 由X、Y和Z三种元素构成的强电解质,对水电离均起抑制作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏属于物理变化 | |
| B. | 油脂在酸性或碱性条件下的水解反应叫做皂化反应 | |
| C. | 石油分馏得到的各馏分都是纯净物 | |
| D. | 淀粉和纤维素在一定条件下水解均可得到葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
实验 | 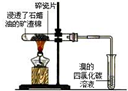 | 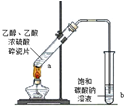 | 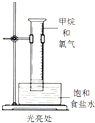 |  |
| 现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 | 量筒内壁产生油状液滴 | 反应过程中钠未熔化成小球 |
解释 | 石蜡油分解产物中 仅含有烯烃 | 反应生成难溶于饱和碳酸钠 溶液的乙酸乙酯 | 甲烷和氯气反应,生成了CH2Cl2、CHCl3、CCl4 | 反应吸热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | NaOH溶液 | C. | KSCN溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com