

| △ |
| y |
| 2 |
| 3y |
| 2 |
| y |
| 2 |
| y |
| 2 |
| 3y |
| 2 |
| 3y |
| 2 |
| y |
| 2 |
| 3y |
| 2 |
| x |
| y |
| 2 |
| 1 |
| 2 |
| 1 |
| x?96% |
| y |
| 2 |
| 1 |
| 3y |
| 2 |
| 3y |
| 2 |
| 3 |
| 2 |


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
 铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+2xH2O═2Fe2O3?xH2O.如图为一放在水槽中的铁架,水位高度如图所示.最容易生锈的铁架横杆是( )
铁生锈是一种常见的自然现象,其主要的化学反应方程式为:4Fe+3O2+2xH2O═2Fe2O3?xH2O.如图为一放在水槽中的铁架,水位高度如图所示.最容易生锈的铁架横杆是( )| A、① | B、② | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、IA族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B、第二周期元素从左到右,最高正价从+1递增到+7,最低负价从-4升高到-1 |
| C、同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D、同周期主族金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.
化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性能.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化:
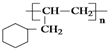 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)查看答案和解析>>
科目:高中化学 来源: 题型:
 糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.查看答案和解析>>
科目:高中化学 来源: 题型:
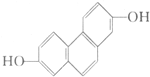 质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:
质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) |
| B、0.1mol?L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、向NH4HSO4的水溶液中逐滴滴入NaOH溶液,至中性的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) |
| D、pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com