
| A. | 干冰中分子的堆积方式为非密堆积 | |
| B. | 金属晶体中原子的最大配位数为12 | |
| C. | 晶体硅熔化时需破坏非极性共价键 | |
| D. | 冰融化为水的过程中其密度先变大,超过4℃后又逐渐变小 |
分析 A、干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;
B、金属为面心立方最密堆积时,配位数最大;
C、晶体硅中硅原子和硅原子之间存在非极性共价键,所以硅熔化时破坏非极性共价键;
D、4℃水的密度最大.
解答 解:A、干冰晶体中,一个CO2分子周围有12个CO2分子紧邻,为密堆积,故A错误;
B、金属为面心立方最密堆积时,配位数最大,配位数为12,故B正确;
C、晶体硅中硅原子和硅原子之间存在非极性共价键,所以硅熔化时破坏非极性共价键,故C正确;
D、4℃水的密度最大,所以冰融化为水的过程中其密度先变大,超过4℃后又逐渐变小,故D正确;
故选A.
点评 本题主要考查了晶体的类型和化学键,分子晶体的堆积方式,注意典型晶体晶胞结构,为学习难点.


科目:高中化学 来源: 题型:选择题
| A. | 无法确定 | B. | NaOH | C. | BaCl2 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠溶液显碱性:S2-+H2O═HS-+OH- | |
| B. | 硫酸铜溶液呈酸性:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| C. | 氯化铝溶液与碳酸钠溶液混合:Al3++CO32-═Al(OH)3↓+H2↑ | |
| D. | 在饱和氯化铵溶液中撒入镁粉后微热:2NH4++Mg═Mg2++2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
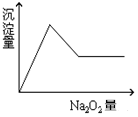 某溶液中可能含有下列8种离子中的一种或几种:H+、Na+、Cu2+、Mg2+、Al3+、NH4+、CO32-、Cl-.向该溶液中加入Na2O2固体放出一种无色无味的气体且产生白色沉淀,沉淀的量随加入Na2O2的量变化关系如图所示.试对该溶液中离子组成情况作出判断.
某溶液中可能含有下列8种离子中的一种或几种:H+、Na+、Cu2+、Mg2+、Al3+、NH4+、CO32-、Cl-.向该溶液中加入Na2O2固体放出一种无色无味的气体且产生白色沉淀,沉淀的量随加入Na2O2的量变化关系如图所示.试对该溶液中离子组成情况作出判断.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酚酞溶液可区别苯酚钠溶液与福尔马林 | |
| B. | 用溴水可区别丙烯与丙烯酸 | |
| C. | 用新制的Cu(OH)2悬浊液可区别醋酸与乙醇 | |
| D. | 无法用溴水除去苯中溶有的少量苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸热反应只有在加热或点燃的条件下才能进行 | |
| B. | H2SO4与Ca(OH)2溶液反应的中和热△H=2×(-57.3kJ•mol-1) | |
| C. | CH4的燃烧热为-890.31kJ•mol-1,它表示1mol CH4完全燃烧生成CO2和液态水时放出890.31kJ热量 | |
| D. | 反应是放热还是吸热由反应物和生成物所具有的能量的相对大小决定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com