
| A、H+、I-、ClO-、Na+ |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Na+、Ca2+、CO32- |
| D、Cu2+、Fe2+、Cl-、SO42- |


科目:高中化学 来源: 题型:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.
甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水果、蔬菜多属于酸性食物 |
| B、煤中加入适量石灰石可减少SO2的排放 |
| C、青霉素是最重要的抗生素,具有消炎的作用 |
| D、误食重金属盐中毒,可通过喝大量牛奶缓解毒性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )| A、NO2是该过程的中间产物 |
| B、NO和O2必须在催化剂表面才能反应催化剂 |
| C、汽车尾气的主要污染成分是CO2和NO |
| D、该催化转化的总反应方程式为:2NO+O2+4CO═4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或事实 | 解 释 |
| A | 用热的烧碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | Ca(OH)2溶液能溶解难溶的杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)浸出K+ | 氢氧根离子与镁离子结合,使平衡向右移动 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4、NaOH、NaNO3都是电解质 |
| B、Na2O、Na2O2、Fe2O3都是碱性氧化物 |
| C、漂白粉、液氨、小苏打都是混合物 |
| D、烧碱、纯碱、熟石灰都是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
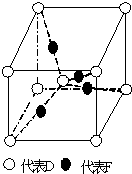 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com