
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
分析 设所给物质的通式为CxHyOz,则其燃烧方程式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O,所以1mol物质消耗氧气的量多少取决于(x+$\frac{y}{4}$-$\frac{z}{2}$),据此解答.
解答 解:①1molC2H2 完全燃烧消耗氧气的物质的量为2+$\frac{2}{4}$=2.5;1molC2H4O完全燃烧消耗氧气的物质的量为2+$\frac{4}{4}$-$\frac{1}{2}$=2.5,二者相等,故选;
②1moC4H8完全燃烧消耗氧气的物质的量为4+$\frac{8}{4}$=6;与C6H12O6完全燃烧消耗氧气的物质的量为6+$\frac{12}{4}$-$\frac{6}{2}$=6,二者相等,故选;
③1moC7H8完全燃烧消耗氧气的物质的量为7+$\frac{8}{4}$=9;与1molC6H12 完全燃烧消耗氧气的物质的量为6+$\frac{12}{4}$=9,二者相等,故选;
④HCOOCH3与CH3COOH互为同分异构体,1mol完全燃烧耗氧量相等,故选;
故选:B.
点评 本题考查了烃及其含氧衍生物燃烧的耗氧量,明确烃及其含氧衍生物燃烧通式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 中和反应是放热反应 | |
| B. |  H2燃烧时的能量变化如图所示 | |
| C. | 化学键断裂放出能量 | |
| D. | 反应物总能量与生成物总能量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题:
X,Y,Z,W为按原子序数由小到大排列的四种短周期的元素,X的阳离子为质子,Y原子有3个能级,各能级电子数相等,Z,W位于同一周期,Z是该周期中金属性最强的元素,W的单质是黑火药的重要成分,含有该单质的某种膏药可治疗某些皮肤病.请回答下列问题: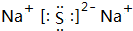 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
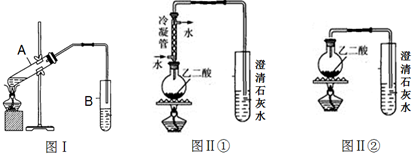
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
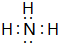 ,空间结构为三角锥形.
,空间结构为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0~a范围内,只发生中和反应 | |
| B. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2 | |
| C. | 原混合溶液中NaOH和Na2CO3的物质的量浓度之比为2:1 | |
| D. | c点对应的溶液中还能大量存在Fe2+、NO3-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸乙酯 | 88 | 0.897 | 77 | 微溶 |
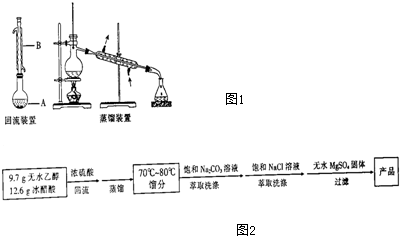
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com