
����Ŀ��
�״�������������ϸ���У���ά�ֹ��������ݵı�Ҫ���ʣ������������������ϵĻ�ѧ��Ӧ���ش��������⣺
��1����̬Pԭ�ӵĺ�������Ų�ʽΪ__________����______��δ�ɶԵ��ӡ�д������ͬ��������Ԫ�ص�һ�����ܵĴ�С˳��_________��
��2����һ��ͬ�������塪�����ף�P4���������Ϊ_________���Ʋ�����CS2�е��ܽ��___________������ڡ���С�ڡ�����ˮ�е��ܽ��
��3��������������̬�⻯��좣�PH3���͵���NH3���ļ��Ƿֱ�Ϊ93.6���107�㣬�Է���PH3���ļ���С��NH3��ԭ��_________��д��һ���뻥Ϊ�ȵ������������_________��
��4��PCl3����ԭ���ӻ��������Ϊ________��VSEPR ģ��Ϊ_______��
��5������BP����һ�ֳ�Ӳ��ĥͿ����ϣ���ͼΪ�������徧�������е�ÿ��ԭ�Ӿ�����8�����ȶ��ṹ�����ж����۵�______������ڡ����ڡ������ʯ�۵㡣
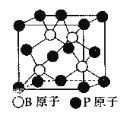
��֪��B-P������Ϊx cm�������ܶ�Ϊ_____g/cm3���г�����ʽ���ɣ�
���𰸡� 1s22p63s23p3 3 P>S>Si��Si>S>P 60�� ���� �縺��Nǿ��P������ԭ�ӵĵ縺��Խ�ɼ��ĵ��Ӷ�������ԭ��Խ�����ɼ����Ӷ�֮�����ԽС���ɼ����Ӷ�֮����ų��������DZ�� H3O+ sp3�ӻ� �������ͣ����������Ͳ����֣� ���� ![]() ��
��
��������(1)Pԭ�ӵĺ˵����Ϊ15�����̬Pԭ�ӵĺ�������Ų�ʽΪ1s22p63s23p3 ��p�������3��δ�ɶԵ��ӣ�ͬ��������Ԫ�صĵ�һ����ͨ����˵���������������ƣ���P��p���Ϊ������ṹ������ȶ�����һ�����ܽϴ���Si��P��S��һ�����ܵĴ�С˳��P>S>Si��
(2)����(P4)����������ṹ��6��P��P����������ȣ��������Ϊ60����P4�Ǻ��зǼ��Լ��ķǼ��Է��ӣ�������������ԭ�����Ʋ����ڷǼ����ܼ�CS2�е��ܽ�ȴ��ڼ����ܼ�ˮ�е��ܽ�ȣ�
(3)��N�ķǽ����Ա�Pǿ����縺��Nǿ��P������ԭ�ӵĵ縺��Խ�ɼ��ĵ��Ӷ�������ԭ��Խ�����ɼ����Ӷ�֮�����ԽС���ɼ����Ӷ�֮����ų��������DZ��PH3�ļ���С��NH3����NH3���ӻ�Ϊ�ȵ������һ������������Ӧ������ͬ�ļ۵�����8��ԭ����4������ΪH3O+��
(4)PCl3��Pԭ�ӵļ۵��Ӷ���3���¶Ե�����Ϊ![]() =1����Pԭ�ӵ��ӻ��������Ϊ sp3�ӻ���VSEPR ģ��Ϊ�������ͣ�
=1����Pԭ�ӵ��ӻ��������Ϊ sp3�ӻ���VSEPR ģ��Ϊ�������ͣ�
(5)�����У�Pλ�ڶ�������ģ���ĿΪ8��![]() +6��
+6��![]() =4��Bλ�ھ����ڣ���ĿΪ4����������Ļ�ѧʽΪBP������������һ�ֳ�Ӳ��ĥͿ����ϣ�����ԭ�Ӿ��壬��C��ԭ�Ӱ뾶��B��P��С����C��C�ļ�����B��P�����̣�����BP���۵�Ƚ��ʯ�ͣ���ͼʾ��֪B-P����Ϊ�Ծ����Խ��ߵ�
=4��Bλ�ھ����ڣ���ĿΪ4����������Ļ�ѧʽΪBP������������һ�ֳ�Ӳ��ĥͿ����ϣ�����ԭ�Ӿ��壬��C��ԭ�Ӱ뾶��B��P��С����C��C�ļ�����B��P�����̣�����BP���۵�Ƚ��ʯ�ͣ���ͼʾ��֪B-P����Ϊ�Ծ����Խ��ߵ�![]() �����߳�Ϊ
�����߳�Ϊ![]() cm�����������Ϊ(
cm�����������Ϊ(![]() cm)3��1mol����������Ϊ4��42g���ʾ������ܶ�Ϊ(4��42g)��[NA��(
cm)3��1mol����������Ϊ4��42g���ʾ������ܶ�Ϊ(4��42g)��[NA��(![]() cm)3]=
cm)3]= g/cm3��
g/cm3��


 �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��·�Ӧ4NH3(g)+5O2(g)=4NO(g)+6H2O(g)��ʼ����ʱ, c��NH3��=0.04mol/L,��5min��c(NH3)=0.03mol/L,��v(NH3)Ϊ
A. 0.002mol/(L��min) B. 0.001mol/(L��min)
C. 0.003mol/(L��min) D. 0.002mol/(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�����һ�ݻ�������ܱ������з������淴Ӧ2X(g) ![]() Y(g)��Z(s)�����²���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����(����)
Y(g)��Z(s)�����²���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����(����)
A. ���������ܶȲ��ٱ仯 B. ��Ӧ������Y��������������
C. X�ķֽ�������Y������������� D. ��λʱ��������1 mol Y��ͬʱ����2 mol X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z����Ԫ�ص�ԭ������֮�͵���42��XԪ��ԭ�ӵ�4p�������3��δ�ɶԵ��ӣ�YԪ��ԭ�ӵ������2p�������2��δ�ɶԵ��ӡ�X��Y���γɻ�����X2Y3��ZԪ�ؿ����γɸ�һ�����ӡ���ش��������⣺
(1)XԪ��ԭ�ӵĻ�̬�����Ų�ʽΪ ����Ԫ�صķ����� ��
(2)YԪ��ԭ�ӵļ۲���ӵĵ����Ų�ͼΪ ����Ԫ�ص������� ��
(3)X��Z���γɻ�����XZ3���û�����Ŀռ乹��Ϊ ��
(4)�Ƚ�X���⻯����ͬ��ڶ���������Ԫ�����γɵ��⻯����ȶ���˳��(�ɴ�С) ���е�˳��(�ɸߵ���) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯������Ҫ���뻹ԭ������ʵ�ֵģ� ��
A.MnO4��Mn2+
B.HCl��Cl2
C.Fe��Fe3+
D.KClO3��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g)����5 L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3 mol����˷�Ӧ��ƽ������Ϊ(����)
4NO(g)��6H2O(g)����5 L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3 mol����˷�Ӧ��ƽ������Ϊ(����)
A. v(O2)��0.01 mol/(L��s) B. v(NO)��0.008 mol/(L��s)
C. v(H2O)��0.003 mol/(L��s) D. v(NH3)��0.004 mol/(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H��0 �����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶�������� ��
CH3CH3COO��+H+ ��H��0 �����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶�������� ��
a����������0.10mol��L��1��ϡ����
b������
c����ˮϡ����0.010mol��L��1
d����������������
e�����������Ȼ��ƹ���
f����������0.10mol��L��1��NaOH��Һ
��2�������ʵ���Ũ�ȵ��������ʵ���Һ����NaCl��CH3COONa ��NH4Cl ��AlCl3 ��Ba(OH)2 ��Na2CO3��NaHCO3��NaHSO4��NaOH ��H2SO4��pHֵ�ɴ�С��˳���ǣ�����ţ� ��
��3�����������Լ�����̪��ʯ�ϡ���ᡢCH3COONa���塢Ũ���ᡢCa(OH)2��ĩ��CH3COONH4���������ˮ�����ݣ���������ˮ�д��ڵ���ƽ�⣻������������ӻ��ƻ�ˮ�ĵ���ƽ�⡣������ƽ����ƶ���������ָʾ����ɫ�ı仯���ɴ˿ɷֱ�ѡ�������Լ����������ʵ��֤��CH3COOH�����ᣬ�����ʵ�鷽��������
��Ӧ�ø�������ʵ�鷽�������� ��
��Ӧ�ø�������ʵ�鷽�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ���Ӧ��N2��3H2![]() 2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�����
2NH3��һ�����ȵĿ��淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�����
(1)��֪1 mol N2��ȫ��Ӧ����NH3�ɷų�92kJ�����������1 mol N2��3 mol H2��ϣ�ʹ���ַ�Ӧ���ų���������С��������ֵ����ԭ����___________________________________��
(2)ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2 L���ܱ������ڣ���Ӧ����10 min������10 mol NH3������N2��ʾ�Ļ�ѧ��Ӧ����Ϊ_______________��
(3)һ�������£����ϳɰ��ķ�Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ����_____________��
a������Ӧ���ʺ��淴Ӧ������� b������Ӧ��������淴Ӧ����Ϊ0
c���������£�N2��ת���ʴﵽ���ֵ d��N2��H2��Ũ�����
e��N2��H2��NH3������������ f������ʱ��ϵѹǿ���ֲ���
��4�����ĸ���ͬ�����У���ͬ�����½��кϳɰ���Ӧ����������ͬʱ���ڲⶨ�Ľ�����жϸ÷�Ӧ�������ɴ�С��˳����__________________________���ñ����д����
A��V(NH3)=0.5 mol L-1-min-1 B��V(H2)=0.3 mol L-1-min-1
C��V(N2)=0.2 mol L-1-min-1 D��V(H2)=0.01 mol L-1- s -1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��Ĥ��ؿɳ�ȥ��ˮ�е������ƺͶ��ȱ��ӣ�![]() ������ԭ������ͼ��ʾ������˵����ȷ����
������ԭ������ͼ��ʾ������˵����ȷ����

A. BΪ��ص�������������ԭ��Ӧ
B. ���������B���ص��߾�С��������A��
C. A���ĵ缫��ӦʽΪ:![]()
D. �����·����0.2mole-ת��ʱ��A�������ӵ�H+����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com